
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)的分解反应。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15 | 20 | 25 | 30 | 35 |
平衡总压强/kPa | 5.7 | 8.3 | 12 | 17.1 | 24 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①该可逆反应的平衡常数的表达式为________________________
②可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中混合气体的密度不变
C.密闭容器中CO2的体积分数不变
D.密闭容器中总压强不变
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25 ℃下达到分解平衡。若在恒温下增大容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
④该反应的焓变ΔH_________0(填“>”、“=”或“<”)
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g) ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式
【答案】(1)①K=c2(NH3)·c(CO2)②BD③减少④>
(2)2CO(g)+SO2(g)=S(s)+2CO2(g)ΔH=-270kJ·mol-1(2’)
【解析】
试题分析:(1)①反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)的K=c2(NH3)c(CO2);②A.2v(NH3)═v(CO2),不能说明正逆反应速率相等,不一定是平衡状态,故A错误;B.密闭容器中混合气体的密度ρ=m/V,质量不守恒,分子变化,V不变,容器中总密度不变,证明达到了平衡状态,故B正确;C.密闭容器中二氧化碳的体积分数始终不变,不能证明达到平恒状态,故C错误;D.反应是一个前后系数和变化的反应,密闭容器中总压强不变,证明达到了平衡状态,故D正确;答案为BD;
2NH3(g)+CO2(g)的K=c2(NH3)c(CO2);②A.2v(NH3)═v(CO2),不能说明正逆反应速率相等,不一定是平衡状态,故A错误;B.密闭容器中混合气体的密度ρ=m/V,质量不守恒,分子变化,V不变,容器中总密度不变,证明达到了平衡状态,故B正确;C.密闭容器中二氧化碳的体积分数始终不变,不能证明达到平恒状态,故C错误;D.反应是一个前后系数和变化的反应,密闭容器中总压强不变,证明达到了平衡状态,故D正确;答案为BD;
③若在恒温下增大容器体积,则会将压强减小,平衡向右移动,固体质量减小;
④根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡正向移动,反应是吸热的,即△H>0;
(2)根据盖斯定律,反应2CO+SO2=S+2CO2的△H=△H1-△H2-△H3=-270 kJmol-1,CO与SO2反应的热化学方程式为2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJmol-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一种白色固体可能由![]() 离子中的若干种组成, 陶宝同学设计实验检验其组成,记录如下:
离子中的若干种组成, 陶宝同学设计实验检验其组成,记录如下:
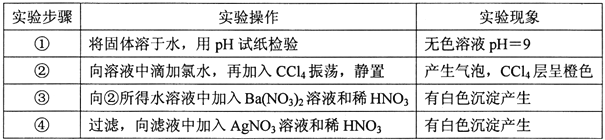
下列关于固体组成的结论错误的是
A. 肯定含有![]() 和
和![]() B. 至少含有
B. 至少含有![]() 中的一种离子
中的一种离子
C. 肯定不含Ba2+,一定含有Cl- D. 无需焰色反应即可断定溶液中含有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是
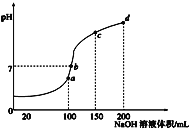
A. a、b、c、d四个点中,水的电离程度最大的是d
B. a点溶液中:c(NH3·H2O)+c(H+)=c(OH—)
C. b点溶液中:c(Na+)+c(NH4+)=2c(SO42—)
D. c点溶液中:c(Na+)= c(SO42—) +c(NH4+)+ c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于下列状态的物质中:①氯化钠固体 ②干冰 ③HCl气体 ④铜 ⑤硫酸钡固体 ⑥蔗糖 ⑦乙醇 ⑧熔融的硝酸钾 ⑨NaCl溶液
(1)能导电的是(填编号,下同) ;
(2)属于电解质的是 ;
(3)属于非电解质的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产、生活离不开化学,下列说法不正确的是( )
A. 泡沫灭火器的反应原理是非氧化还原反应
B. 钢铁析氢腐蚀和吸氧腐蚀的速率一样快
C. 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
D. 燃料电池的燃料都在负极发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一。
(1)铜元素基态原子的价电子排布式为_______,其核外能级能量的高低3d______4s(填“>”、“<”或“=”)
(2)Cu与元素A能形成如下图所示的两种化合物甲和乙。元素A是短周期非金属元素,A的常见氧化物常温下为液态,其熔沸点比同主族其他元素的氧化物高。
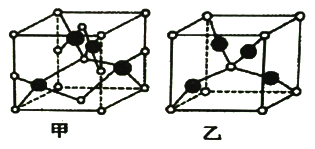
① 两种化合物的化学式分别为:甲___________,乙___________。
② 热稳定性甲_________乙(填“>”、“<”或“=”),试从原子结构上解释原因____。
(3)铜离子形成的某种配合物阳离子具有轴向狭长的八面体结构(如下图)。
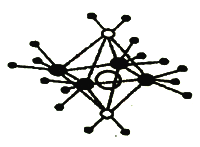
已知两种配体都是10电子的中性分子,且都含氢元素。
① 两种配体分子的配位原子电负性大小为______(填元素符号),其中热稳定性较弱的配体为(用电子式表示)__________。
② 该配合物阳离子与SO42-形成的配合物X的化学式为_________.
(4)Cu单质的晶体为面心立方堆积,其晶胞立方体的边长为acm, Cu的相对原子质量为63.5,单质Cu的密度为ρg/cm3,则阿伏加德罗常数可表示为_____mol-1(含“a、ρ的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com