
【题目】如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24L。下列说法正确的是( )

A.A池为电解池,B池为原电池
B.D、E两极都发生氧化反应
C.E极应为粗铜板材料
D.B池中E极质量增加12.8g
【答案】D
【解析】
已知A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24L,电解NaOH溶液,在阳极生成氧气具有氧化性,阴极生成氢气,则可判断D极为电解池A的阳极,C为阴极;则E电极为阴极,F电极为阳极;则可推得A池电解氢氧化钠溶液,D电极生成氧气,C电极生成氢气;B池精炼铜,阳极F为粗铜,E电极为精铜,据此解答。
已知A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24L,电解NaOH溶液,在阳极生成氧气具有氧化性,阴极生成氢气,则可判断D极为电解池A的阳极,C为阴极;则E电极为阴极,F电极为阳极;则可推得A池电解氢氧化钠溶液,D电极生成氧气,C电极生成氢气;B池精炼铜,阳极F为粗铜,E电极为精铜,
A. 有外接电源,A、B都为电解池,A项错误;
B. 电解池中阳极上发生氧化反应,所以应为D、F电极上发生氧化反应,C、E电极上发生还原反应,B项错误;
C. 由以上分析可知,B池精炼铜,阳极F为粗铜,E电极为精铜;C项错误;
D. B池中E极为电解池阴极,电极反应Cu2++2e=Cu,质量增加为铜,A池中D电极生成氧气,电极反应:4OH4e=2H2O+O2↑,生成氧气物质的量为0.1mol,失电子物质的量为0.4mol,根据串联电解池中转移电子数相等,可知E极得电子为0.4mol,则生成铜0.2mol,质量为12.8g,D项正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过___方法区分晶体、准晶体和非晶体。
(2)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___(填字母代号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。

a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(4)配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ),是铜的一种重要化合物。其中En 是乙二胺(H2N-CH2-CH2-NH2)的简写。
①该配合物中含有化学键有___(填字母编号)。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.金属键
②配体乙二胺分子中氮原子、碳原子轨道的杂化类型分别为___、___。
③乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是___。
④乙二胺(H2NCH2CH2NH2)是一种有机化合物,乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___,其中与乙二胺形成的化合物稳定性相对较高的是___(填“Mg2+”或“Cu2+”)。
⑤与氨气互为等电子体的阳离子为___,与S位于同一周期,且第一电离能小于S的非金属元素符号为___。
(5)①金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为____。

A. B.
B.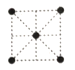 C.
C. D.
D.
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=__g·cm-3。
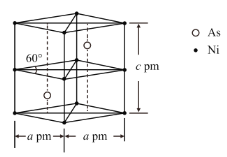
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取浓度均为0.1 mol·L1的醋酸溶液和氨水各20 mL,分别用0.1 mol·L1 氢氧化钠溶液和0.1 mol·L1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
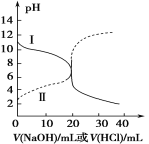
A.曲线I,滴加10 mL溶液时:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.曲线I,滴加20 mL溶液时:两溶液恰好完全反应,此时溶液的pH<7
C.曲线II,滴加溶液体积在10~20 mL之间时存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线II,滴加30 mL溶液时:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设水的电离平衡线如右图所示。
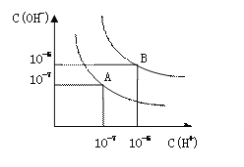
(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从___________增加到____________;
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐酸的体积比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Zn(s) +![]() O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
Hg(l) +![]() O2(g) = HgO(s) ΔH2=-90.7kJ/mol
O2(g) = HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中ΔH3的值是
A.-260.4 kJ/molB.-254.6 kJ/molC.-438.9 kJ/molD.-441.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,装置正确且能达到实验目的的是
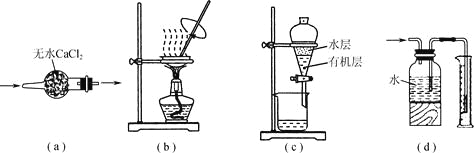
A.用图a所示装置干燥SO2气体
B.用图b所示装置蒸发CH3COONa溶液得醋酸钠晶体
C.用图c所示装置分离有机层与水层,水层从分液漏斗下口放出
D.用图d所示装置测量氯气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,加压有利于氨的合成
D.Fe(SCN)3溶液中加入NaOH后溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ/mol
B. 一定条件下,将0.5 molN2和1.5molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ/mol
2NH3(g)△H=﹣38.6kJ/mol
C. 已知2C(s)+2O2(g) ═2CO2(g);△H1;2C(s)+O2(g)=2CO(g) △H2 则△H1>△H2
D. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类生活中最常见、应用最广泛的金属,钢铁在空气中很容易被腐蚀。
(1)炒过菜的铁锅未及时洗净(残液中含有 NaCl),不久便会因腐蚀而出现褐色锈斑。铁锅锈蚀的电极反应式为:负极___________________________,正极___________________________。
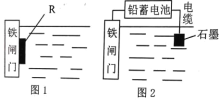
(2)为了降低某水库的铁闸门的腐蚀速率,可以采用图 1 所示的方案,其中焊接在铁闸门上的固体材料 R 可以采用 _______________ (填序号)。
A、铜 B、锌 C、钠 D、石墨
(3)图 2 所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在铅蓄电池的_______极上(填“正”或“负”)。
(4)常温下以铅蓄电池为电源,用石墨作电极电解 1L 0.1mol/L NaCl溶液,电解一段时间后,测得溶液的 pH 为 13,则铅蓄电池中转移电子的物质的量为__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com