
(10分)760℃和101.3kPa下,令氢气和氦气(体积比为1 :1)慢慢通过盛有熔融AgBr的舟皿,而使部分AgBr还原为Ag。然后让反应后的气体通过盛有40.00 mL 0.1000 mol?L-1NaOH的洗气瓶(溴单质被NaOH溶液吸收时,所生成的盐是两种强酸盐),并收集干燥后的尾气。某次实验后,洗气瓶内的溶液可以被l0.00 mL 0.1000 mol?L-1的HCl溶液中和,并在27.0℃ 101.3kPa下收集得干燥尾气492.4mL(已知760℃时纯HBr气体有16.67%分解为单质)。
(1)写出该实验过程中所发生的全部反应的方程式,并配平。
(2)计算舟皿中银单质的物质的量。
(3)计算尾气中氢气的物质的量。
(1)除方程式(4)为1分,余皆0.5分一个,共3分
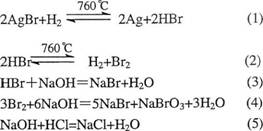
(2) 反应㈣产生的HBr,在反应(2)中部分分解,由反应(1),(2)的化学计量数可知,反应(1)产生的HBr的总物质的量为:n(HBr)+2n(Br2),此也是反应(1)生成的Ag的物质的量。由前述方程式(3)(4)(5)可知:n(HBr)+2n(Br2)=3.000×10-3mol,n(Ag)= 3.000×10-3mol (2分)
(3)a.由上述方程式可知,干燥尾气中仅有稀有气体和氢气,所以
n(稀)+n(H2)=PV/RT:101.3×0.4924/(8.314×300.0)=2.000×10-2(mo1) (1分)(用其他方法求得此结果也给分)
由原始气体的体积比,可知稀有气体和氢气的物质的量相等;又由反应(1)、(2)可知,通过舟皿后体系中HBr的物质的量,是被消耗的H2的物质的量的2倍,故有:
尾气:![]()
![]()
由反应(3)、(4)可知
![]()

也即:![]()
解(1)、(2)、(3)联立方程组,可求得n(H2)=9.255×10-3mol(2分,考虑到计算过程的差异,计算结果在9.2×10-3~9.3×10-3之间,皆可得2分,但若解题方法不正确,则不得分)特别提醒:第(3)小题在解答中,有些选手由于审题不严,没有注意“纯HBr气体”的前提条件,误认为H2与AgBr反应后生成HBr和Ag、HBr再部分分解为H2和Br2时,HBr的分解率也是16.67%.事实上,此时的分解率比“纯HBr气体”的要小。直接造成的后果是,这些选手很可能会从守恒法解答此题,下面是可能的错误解法之一:
根据Na元素和Br元素的原子守恒,可知H2和AgBr反应产生的HBr的初始总量为(40mL-1OmL)×O.Imol/L×10-3,则根据反应(1)可知反应掉氢气的量为1.5×10-3moI,HBr又有16.67%分解产生1/2X3.O×O.1667×10-3moI的氢气。剩余尾气的量应为总气体量减去反应掉的氢气再加上重新生成的氢气的量。
假设原先通入的氢气和氦气都是X mol
2x-1.5×10-3 + 1/2×3.O×0.1667×10-3=(0.4924/22.4)×(273/300)=O.02
解出x=O.01062moI,剩余氢气的物质的量为剩余尾气总量减去氦气的量为9.38×10-3mol。
虽然此值与正确答案相差不太大,但在HBr分解率概念的理解上有本质的错误,故不能


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com