

分析 (1)①猜想其产物为CO、CO2和H2O,草酸在100℃时开始升华,157℃时大量升华,并开始分解.草酸钙不溶于水、草酸蒸气能使澄清石灰水变浑浊、草酸蒸气在低温下可冷凝为固体,分析可知先冷凝挥发出的草酸,再检验水蒸气的生成,检验二氧化碳的生成,并除去二氧化碳,再通过灼热的氧化铜检验一氧化碳气体的存在,利用反应后生成的二氧化碳通入澄清石灰水变浑浊证明一氧化碳的存在;
②CO为可燃性气体,加热之前必须验纯,碱石灰可以吸收草酸分解产生的二氧化碳和水,进而提高CO的浓度,检验产物中CO的实验现象是C中黑色氧化铜变红色,生成了澄清石灰水变浑浊的气体;
③一氧化碳有毒,会污染空气,需要吸收处理装置;
(2)证明草酸具有弱酸性,需要证明草酸在溶液中部分电离,存在电离平衡;
(3)依据氧化还原反应元素化合价变化和电子守恒、原子守恒配平得到反应的离子方程式.
解答 解:(1)①分解产物为CO、CO2和H2O,检验时应该先用无水硫酸铜检验水蒸气,然后用澄清石灰水检验二氧化碳,最后用加热的CuO和澄清石灰水检验CO,所以仪器的连接顺序为:A→C→D→E→B→D,
故答案为:C;E;
②CO为可燃性气体,所以在点燃B处酒精灯之前必须验纯,收集D处气体,检验CO气体的纯度,碱石灰可以吸收草酸分解产生的二氧化碳和水,进而提高CO的浓度,装置中碱石灰的作用是:除去气体中的CO2 和水,提高CO的浓度,当装置B中黑色固体变成红色,且装置D澄清石灰水变浑浊,则证明混合气体中含有CO,
故答案为:收集D处气体,检验CO气体的纯度;除去气体中的CO2 和水,提高CO的浓度;黑色固体变成红色,且澄清石灰水变浑浊;
③一氧化碳有毒污染空气,需要吸收处理装置,一氧化碳尾气的处理方法为点燃,操作时将气体通到酒精灯火焰上燃烧,
故答案为:没有一氧化碳尾气处理装置;
(2)A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色,只能说明酸碱反应,不能说明草酸是弱酸,故A错误;
B.草酸和硫酸都是二元酸,测定相同浓度的草酸和硫酸溶液的pH,若不同PH大的为草酸证明存在电离平衡,故B正确;
C.测定草酸钠(Na2C2O4)溶液的pH,若显碱性,证明草酸根离子水解,证明草酸是弱酸,故C正确;
D.将草酸溶液加入Na2CO3溶液中,有CO2放出,只能说明草酸酸性大于碳酸,但不能证明草酸是弱酸,故D错误;
故选BC,
故答案为:BC;
(3)根据氧化还原反应方程式的配平原则:锰元素化合价+7价变化为+2价,电子转移5,草酸中碳元素化合价+3价变化为+4价,得失电子守恒、质量守恒和电荷守恒配平该反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
点评 本题考查了性质实验方案设计的方法,涉及化学实验、氧化还原反应、离子反应及电解质溶液中粒子行为和化学计算相关知识,题目难度中等,注意掌握探究物质性质实验方案设计的方法,明确物质性质及实验操作方法为解答关键,试题有利于提高学生的分析、理解能力及化学实验能力.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:推断题
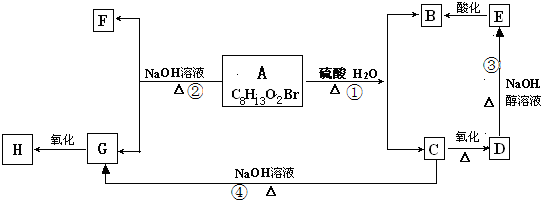
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2的量减少 | B. | 平衡逆向移动 | C. | ν(正)>ν(逆) | D. | HI转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.09mol | B. | 0.11mol | C. | 0.12mol | D. | 0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HI>HBr>HCl>HF | B. | 还原性强弱:F->Cl->I- | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 原子半径大小:Na>S>O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
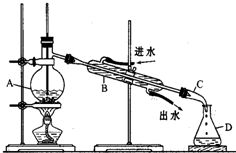 某同学设计了如下装置进行石油蒸馏的实验,回答下列有关问题:
某同学设计了如下装置进行石油蒸馏的实验,回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4++H2O?NH3•H2O+H+ | B. | Fe3++3H2O═Fe(OH)3↓+3H+ | ||
| C. | S2-+2H2O═H2S+2OH- | D. | Br-+H2O═HBr+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅用酸性高锰酸钾溶液可区分苯和甲苯 | |
| B. | 仅用氯化铁溶液可区分苯酚稀溶液和甘油 | |
| C. | 仅用硝酸和硝酸银溶液可验证卤代烃中卤原子的种类 | |
| D. | 仅用溴的四氯化碳溶液可区别液态的植物油和动物油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com