
| A. | 最终两容器中的气体压强相同 | B. | 最终两容器中的气体密度相同 | ||
| C. | A中反应时有2NA个电子转移 | D. | 最终A中气体物质的量为1.5mol |
分析 A充入的1molO2和1molNO发生反应生成1mol二氧化氮,反应后还剩余0.5mol氧气,且部分二氧化氮转化成四氧化二氮,导致气体的总物质的量小于1.5mol;B中气体的物质的量为2mol,
A.最终A、B中气体总物质的量不相等,则压强不相等;
B.密度ρ=$\frac{m}{V}$,两容器的体积相等,但气体的总质量不相等,则密度不相等;
C.1molNO完全反应生成1mol二氧化氮,转移了2mol电子;
D.根据分析可知,A中气体的总物质的量小于1.5mol.
解答 解:A充入的1molO2和1molNO发生反应生成1mol二氧化氮,反应后还剩余0.5mol氧气,且部分二氧化氮转化成四氧化二氮,导致气体的总物质的量小于1.5mol;B中气体的物质的量为2mol,
A.容器的容积固定,则压强与气体的总物质的量成正比,由于两容器中气体的物质的量不相等,则压强不相等,故A错误;
B.A充入1molO2和1molNO的总质量为:32g+28g=60g,B中1mol硫化氢的质量为34g,根据ρ=$\frac{m}{V}$可知,容器容积相等,但气体的总质量不相等,所以密度不相等,故B错误;
C.A中1molNO完全反应消耗0.5mol氧气生成1mol二氧化氮,转移了2mol电子,反应时有2NA个电子转移,故C正确;
D.由于部分二氧化氮转化成四氧化二氮,导致气体物质的量减小,则反应后气体的总物质的量小于1.5mol,故D错误;
故选C.
点评 本题考查了阿伏伽德罗定律及其推论的应用,题目难度中等,明确阿伏伽德罗定律的内容为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力,D为易错点,注意部分二氧化氮转化成四氧化二氮,导致气体的总物质的量减小.


科目:高中化学 来源: 题型:选择题
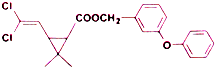
| A. | 分子式为C21H20O3Cl2 | |
| B. | 醚键上的氧原子至少与另外11个原子共面 | |
| C. | 分子中不存在手性碳原子 | |
| D. | 在一定条件下可发生加成、取代、氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 NaOH溶液 | B. | 2 mol•L-1HCl溶液 | ||
| C. | 3 mol•L-1 NaCl溶液 | D. | 酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:16 | B. | 16:1 | C. | 17:7 | D. | 5:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学式 | NH3•H2O | HCN | CH3COOH | H2CO3 |
| 电离平衡常数(25℃) | Kb=1.77×10-5 | Ka=4.93×10-10 | Ka=1.76×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com