

分析 (1)该反应中S元素化合价由+4价变为+6价、Cr元素化合价由+6价变为+3价,转移电子数为6,根据转移电子相等配平方程式得;得电子化合价降低的元素被还原;
(2)过量的SO2通入Na2S溶液,二者发生氧化还原反应生成S,同时生成亚硫酸氢钠;
(3)n(NaOH)=0.3mol/L×1L=0.3mol,n(SO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,设生成Na2SO3、NaHSO3的物质的量分别是xmol、ymol,根据Na、S原子守恒得x+y=0.22x+y=0.3解得,x=0.1mol,y=0.1mol,所以溶液中的溶质是等物质的量的Na2SO3、NaHSO3,溶液中存在电荷守恒、物料守恒和质子守恒;
(4)①碳酸钠溶液中通入过量的二氧化硫反应生成亚硫酸氢钠和二氧化碳;
②二氧化硫为酸性氧化物,能够与氢氧化钙溶液反应,可以用氢氧化钙吸收二氧化硫.
解答 解:(1)该反应中S元素化合价由+4价变为+6价、Cr元素化合价由+6价变为+3价,转移电子数为6,根据转移电子相等配平方程式3SO2+K2Cr2O7+11H2O+H2SO4=2KCr(SO4)2.12H2O;得电子化合价降低的元素被还原,则Cr元素被还原,
故答案为:3SO2+K2Cr2O7+11H2O+H2SO4=2KCr(SO4)2.12H2O;Cr;
(2)过量的SO2通入Na2S溶液,二者发生氧化还原反应生成S,同时生成亚硫酸氢钠,离子方程式为2H2O+2S2-+5SO2=4HSO3-+3S↓,
故答案为:2H2O+2S2-+5SO2=4HSO3-+3S↓;
(3)n(NaOH)=0.3mol/L×1L=0.3mol,n(SO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,设生成Na2SO3、NaHSO3的物质的量分别是xmol、ymol,根据Na、S原子守恒得x+y=0.22x+y=0.3解得,x=0.1mol,y=0.1mol,所以溶液中的溶质是等物质的量的Na2SO3、NaHSO3,溶液中存在电荷守恒、物料守恒和质子守恒,根据电荷守恒得c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),根据物料守恒得2c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3),]),[SO32-]+[HSO3-]+[H2SO3]=0.2mol/L,根据质子守恒得c(HSO3-)+3c(H2SO3)+2c(H+)=c(SO32-)+2c(OH-),
故答案为:2c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3),[SO32-]+[HSO3-]+[H2SO3]=0.2mol/L或c(HSO3-)+3c(H2SO3)+2c(H+)=c(SO32-)+2c(OH-);
(4)①碳酸钠溶液中通入过量的二氧化硫反应生成亚硫酸氢钠和二氧化碳,离子方程式:H2O+2SO2+CO32-═2HSO3-+CO2;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2;
②二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应,可以用氢氧化钠吸收二氧化硫;
故答案为:NaOH.
点评 本题为综合题,考查含硫物质的综合应用,涉及氧化还原反应、复分解反应、盐类水解、离子浓度大小比较、弱电解质的电离等知识点,明确二氧化硫的性质及离子方程式方法是解题关键,题目难度中等.


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:实验题
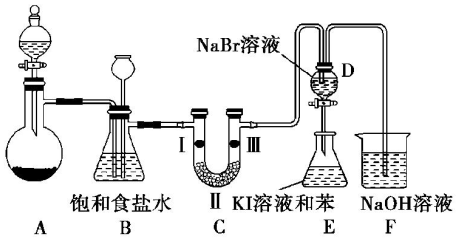
| a | b | c | |
| Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
 .打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象不能( 填“能”或“不能”)说明Br2的氧化性大于I2.
.打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象不能( 填“能”或“不能”)说明Br2的氧化性大于I2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| H2 | SO2 | H2 | SO2 | ||
| 容器Ⅰ | 300 | 0.3 | 0.1 | 0.02 | |
| 容器Ⅱ | 300 | 0.6 | 0.2 | ||
| 容器Ⅲ | 240 | 0.3 | 0.1 | 0.01 | |
| A. | 该反应正反应为吸热反应 | |
| B. | 容器Ⅲ达到平衡的时间比容器I短 | |
| C. | 240℃时,该反应的平衡常数为1.08×104 | |
| D. | 容器Ⅱ达到平衡时SO2的转化率比容器I小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molN2与3 mol H2反应生成的NH3分子数为2NA | |
| B. | 2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA | |
| C. | 标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA | |
| D. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:25℃时Ksp(BaSO4)=1.0×10-10.该温度下,CaSO4悬浊液中,c(Ca2+)与c(SO42-)的关系如图所示,下列叙述正确的是( )
已知:25℃时Ksp(BaSO4)=1.0×10-10.该温度下,CaSO4悬浊液中,c(Ca2+)与c(SO42-)的关系如图所示,下列叙述正确的是( )| A. | 向a点的溶液中加入等物质的量固体Na2SO4或Ca(NO3)2,析出的沉淀量不同 | |
| B. | a、b、c、d四点对应的体系中,d点体系最稳定 | |
| C. | 升高温度后,溶液可能会由a点转化为b点 | |
| D. | 反应Ba2+(aq)+CaSO4(s)?BaSO4(s)+Ca2+(aq)的平衡常数K=9×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制备氨气 | 将浓氨水逐滴滴入CaO固体中 |
| B | 制备氯气 | 将浓盐酸逐滴滴入浓硫酸 |
| C | 制备氧气 | 向双氧水中滴入ZnSO4溶液 |
| D | 制备氢气 | 酒精灯加热碳与水的混合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com