
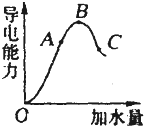
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答:

科目:高中化学 来源: 题型:
| A、5.6g铁在足量氯气中燃烧,电子转移0.3NA个 |
| B、标准状况下,2.24L水中含有0.1NA个水分子 |
| C、1.12L氯气中反应0.1NA个氯原子 |
| D、12g石墨和C60的混合固体中,含碳原子NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水. | 现象:溶液变成黄色. 结论: |
| 步骤2: | 现象: 结论: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定条件下,催化分解80g SO3,混合气体中氧原子数为3×6.02×1023 |
| B、一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8×6.02×1023 |
| C、100mL 1mol/L AlCl3与3mol/L NaCl的混合溶液中,Cl-的个数为0.6×6.02×1023 |
| D、含有非极性键的数目为6.02×1023的Na2O2与水充分反应,标况下产生O2 22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性 |
| B、常温时的溶解度 |
| C、常温时同浓度的pH |
| D、与含1mol HCl的盐酸完全反应时所需的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除③外 | B、除②外 |
| C、除②③⑤外 | D、除②⑤外 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com