
| A. | X的金属性比Y的金属性强 | |
| B. | 常温下,X和Y都不能从水中置换出氢 | |
| C. | Y元素的氢氧化物碱性比X元素的氢氧化物碱性大 | |
| D. | X元素的最高化合价比Y元素的最高化合价低 |
分析 X和Y元素的原子在化学反应中都易失去电子而形成与Ne相同的电子层结构,则X、Y均为第三周期的金属元素,X的原子序数比Y的原子序数大,则X的金属性小于Y的金属性,据此解答.
解答 解:X和Y元素的原子在化学反应中都易失去电子而形成与Ne相同的电子层结构,则X、Y均为第三周期的金属元素,X的原子序数比Y的原子序数大,则X的金属性小于Y的金属性,
A.同周期,随原子序数增大,元素金属性减弱,则X的金属性比Y的金属性弱,故A错误;
B.Y为Na时,与水发生反应:2Na+2H2O═2NaOH+H2↑,故B错误;
C.金属性越强,对应的氢氧化物的碱性越强,X的金属性小于Y的金属性,则Y元素的氢氧化物碱性比X元素的氢氧化物碱性强,故C正确;
D.同一周期主族元素,元素最高正化合价随着原子序数增大而增大(O、F元素除外),X、Y为第三周期金属元素,X的原子序数比Y的原子序数大,则X元素的最高化合价比Y元素的最高化合价高,故D错误,
故选C.
点评 本题考查结构性质位置关系应用,明确元素为第三周期的金属元素是解答本题的关键,题目难度不大,注意理解掌握元素周期律.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷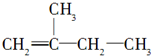 2-甲基-1丁烯
2-甲基-1丁烯 .
. .
. 分子式为C10H20,按碳的骨架分,该有机物属于ab.(填字母序号)
分子式为C10H20,按碳的骨架分,该有机物属于ab.(填字母序号)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有同质量、不同体积的N2O和CO2 | B. | 具有同温度、同体积的CO和N2 | ||
| C. | 具有同体积、同密度的SO2和NO2 | D. | 具有同密度、不同质量的O2和O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NiMH 电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 充电过程中OH-离子从阳极向阴极迁移 | |
| C. | 充电过程中阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原 | |
| D. | 放电是OH-离子从正极向负极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溴水、铁粉和苯混合加热即可制得溴苯 | |
| B. | 除去溴苯中红棕色的溴,可用稀NaOH溶液反复洗涤,再用分液漏斗分液 | |
| C. | 用苯和浓HNO3、浓H2SO4反应制取硝基苯时需水浴加热,温度计应放在反应混合液中 | |
| D. | 制取硝基苯时,应先向试管中加入浓H2SO4 2 mL,再加入1.5 mL浓HNO3,再滴入苯约1 mL,然后放在水浴中加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
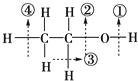
| A. | 与金属钠反应时键①断裂 | |
| B. | 与乙酸发生酯化反应时键①断裂 | |
| C. | 与浓硫酸共热到170℃时键③、④断裂 | |
| D. | 在铜催化下与氧气反应时键①、③断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示).
A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 信息产业中的光缆的主要成份是单质硅 | |
| B. | NO2、CO2、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸氢钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com