
| A. | ②⑤ | B. | ①②③ | C. | ①②③⑤ | D. | 全部 |
分析 比较元素的非金属性强弱,可从与氢气反应的剧烈程度、氢化物的稳定性、最高价氧化物对应水化物的酸性强弱等角度判断,注意不能根据得失电子的多少以及熔沸点的高低等角度判断.
解答 解:①非金属单质M能从N的化合物中置换出非金属单质N,可说明M比N的非金属性强,故①正确;
②M原子比N原子容易得到电子,可说明M比N的非金属性强,故②正确;
③单质M跟H2反应比N跟H2反应容易得多,则M易得电子,所以M比N的非金属性强,故③正确;
④不能利用氢化物的水溶液的酸性比较非金属性的强弱,故④错误;
⑤氧化物水化物的酸性HmMOx>HnNOy,不一定为最高价氧化物对应的水化物的酸性,则不能说明M、N的非金属性强弱,故⑤错误;
⑥M的单质熔点比N的高,属于物理性质,与得失电子的能力无关,不能用来判断非金属性的强弱,故⑥错误.
正确的有①②③,故选B.
点评 本题考查非金属性的比较,题目难度不大,本题注意把握比较非金属性的角度,注意元素周期律的变化.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
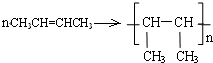 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳酸:CH3-CH(OH)-COOH | |
| B. | 甘油:CH2(OH)-CH(OH)-CH2(OH) | |
| C. | 脱氧核糖:CH2(OH)-CH(OH)-CH(OH)-CH2-CHO | |
| D. | 核糖:CH2(OH)-CH(OH)-CH(OH)-CH(OH)-CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 41 | B. | 115 | C. | 142 | D. | 162 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 治理“地沟油”,可通过水解反应制得肥皂 | |
| B. | 硅晶体具有半导体性能,可用于制取光导纤维 | |
| C. | 人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 | |
| D. | PM2.5是指空气中直径≤2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体(1μm=10-6m) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
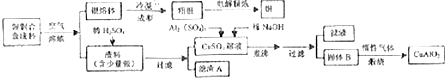
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| C. | AlCl3溶液中加入过量的氨水:Al3++4OH-=AlO2-+2H2O | |
| D. | 向NaHCO3溶液中加入过量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
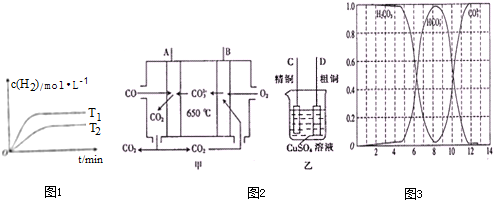
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com