
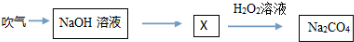
| A、Na2CO4是一种盐,其中碳为+6价 |
| B、X溶液中可能含两种盐 |
| C、该过程中没有发生氧化还原反应 |
| D、NaHCO3与盐酸和氢氧化钠均能反应 |


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、纳米Fe3O4分散在适当溶剂中,当强光照射时,会产生丁达尔现象 |
| B、反应①的反应类型为消去反应 |
| C、反应②中,环丙胺的作用可能是促进氯化铁水解 |
| D、反应③的化学方程式为:6FeOOH+CO═2Fe3 O4+3H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中NH4+和OH-在加热时可生成NH3 |
| B、铵盐受热分解均有生成NH3放出 |
| C、铵盐均易溶于水 |
| D、铵盐属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| A、85.5% |
| B、66.7% |
| C、33.3% |
| D、27.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用分液漏斗分离乙醇和水 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用加热的方法分离氯化钠和硝酸钾固体 |
| D、用四氯化碳萃取碘的饱和水溶液中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )| A、4NH2(g)+5O2(g)?4NO(g)+6H2O(g)△H=-808.7Kj/mol |
| B、N2O3(g)?NO2(g)+NO(g)△H=+41.8Kj/mol |
| C、3NO2(g)+H2O(l)?2HNO2(l)+NO(g)△H=-261.3Kj/mol |
| D、CO2(g)+C(s)?2CO(g)△H=+171.4Kj/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com