
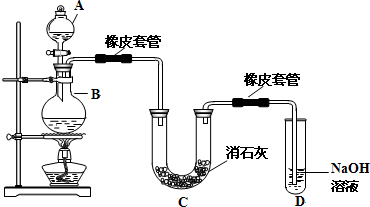
分析 (1)A仪器名称是分液漏斗,所盛放试剂是液体浓盐酸,加热条件下,浓盐酸和二氧化锰发生氧化还原反应;
(2)氯气和消石灰反应生成氯化钙、次氯酸钙和水;
(3)两个副反应:度较高时氯气与消石灰反应生成Ca(ClO3)2,另一个副反应为盐酸和氢氧化钙反应;
①因为温度高时易生成Ca(ClO3)2,所以避免此反应发生可以采取降温措施;
②装置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应;
(4)根据化合价变化计算转移电子的物质的量,根据原子守恒计算被氧化的氯化氢的量,根据氯气和漂白精之间的关系进行计算.
解答 解:(1)装置中添加浓盐酸通过分液漏斗,所以A仪器名称是分液漏斗,加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,
故答案为:分液漏斗;浓盐酸;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
(2)漂白粉将在U形管中产生,是氯气和氢氧化钙反应生成氯化钙、次氯酸钙、水;其化学方程式为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
故答案为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
(3)两个副反应:度较高时氯气与消石灰反应生成Ca(ClO3)2,反应为:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O,氯化氢易挥发,制取的氯气中含有氯化氢,所以另一个副反应为盐酸和氢氧化钙反应:2HCl+Ca(OH)2=CaCl2+2H2O,
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,将U形管置于冷水浴中;
②置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应,反应的化学方程式为:2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置,
故答案为:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O、2HCl+Ca(OH)2=CaCl2+2H2O;将U形管置于冷水浴中;2HCl+Ca(OH)2=CaCl2+2H2O;在B、C之间增加一个饱和食盐水洗气装置;
(4)该反应中每生成1 mol Cl2,转移电子的物质的量=1mol×(1-0)×1=1mol,根据原子守恒知,被氧化的HCl的物质的量为1mol,
Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,根据方程式可以得到漂白精加盐酸所释放的氯气的质量=$\frac{71×2}{143}$m[Ca(ClO)2]=99.3%×m[Ca(ClO)2],所以漂白精的质量=$\frac{99.3%}{65%}$×m[Ca(ClO)2]=152.8%×m[Ca(ClO)2],所以该漂粉精中Ca(ClO)2的质量分数=$\frac{1}{152.8%}$=65.5%,
故答案为:1;1;65.5%.
点评 本题考查了实验室制取氯气、漂白粉的反应原理和化学方程式的应用,实验过程中的反应特征和反应判断,注意有效氯的计算方法,为解题难点,题目难度中等.


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 水溶性:乙醇>新戊烷>苯酚 | |
| B. | 同质量的物质燃烧消耗O2量:乙烷>甲烷>乙炔 | |
| C. | 密度:水>苯>硝基苯 | |
| D. | 沸点:正戊烷>异戊烷>新戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
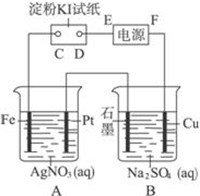 室温下,用下图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.若电解结束时,A、B装置中共收集到气体1.68L(标准状况),假设电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求此时A溶液的pH值.(提示:pH=-lgc(H+))
室温下,用下图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.若电解结束时,A、B装置中共收集到气体1.68L(标准状况),假设电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求此时A溶液的pH值.(提示:pH=-lgc(H+))查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 苹果酸在一定条件下能跟乙酸发生酯化反应 | |
| B. | 苹果酸在一定条件下能与金属钠反应 | |
| C. | 苹果酸在一定条件下能跟乙醇发生酯化反应 | |
| D. | 1 mol苹果酸与Na2CO3溶液反应最多消耗3 mol Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量时,将胆矾晶体直接放在托盘天平的右盘上 | |
| B. | 准确称取16.0g胆矾,溶于水,待溶液恢复到室温,转移至1000mL容量瓶中,定容 | |
| C. | 准确称取25.0g胆矾,溶于水,待溶液恢复到室温,转移至1000mL容量瓶中,定容 | |
| D. | 定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 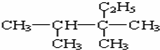 ,3,3-三甲基戊烷 ,3,3-三甲基戊烷 | B. | 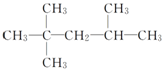 2,2,4三甲基戊烷 2,2,4三甲基戊烷 | ||
| C. | (CH3CH2)2CHCH3 3甲基戊烷 | D. | 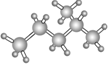 异戊烷 异戊烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com