
| A. | 粗硅制备单晶硅不涉及氧化还原反应 | |
| B. | 硅胶常用做实验时和袋装食品、瓶装药品的干燥剂 | |
| C. | 纯净的硅可做光导纤维的原料 | |
| D. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
分析 A.粗硅精炼是二氧化硅和碳反应生成硅和一氧化碳,精炼过程中粗硅和氯气反应生成四氯化硅,被氢气还原得到晶体硅,依据反应中元素化合价变化分析判断;
B.硅胶具有吸水性;
C.光导纤维的主要成分是二氧化硅;
D.水晶的成分是二氧化硅.
解答 解:A.粗硅精炼是二氧化硅和碳反应生成硅和一氧化碳,精炼过程中粗硅和氯气反应生成四氯化硅,被氢气还原得到晶体硅,发生的反应中元素化合价发生变化,是氧化还原反应,故A错误;
B.硅胶具有吸水性,所以硅胶可用作催化剂的载体,常用做实验时和袋装食品、瓶装药品的干燥剂,故B正确;
C.光导纤维的主要成分是二氧化硅,纯净的硅可做半导体材料,故C错误;
D.水晶的成分是二氧化硅,不是硅酸盐产品,餐桌上的瓷盘是硅酸盐制品,故D错误.
故选B.
点评 本题考查了元素化合物知识,侧重考查物质的用途,性质决定用途,明确物质的性质是解题关键,题目难度不大.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 失电子越多,还原性就越强,得电子越多,氧化性越强 | |
| B. | 金属单质在化学反应中一定作为还原剂,非金属单质在反应中可以作氧化剂 | |
| C. | 强电解质溶液的导电能力一定强,弱电解质溶液的导电能力一定弱 | |
| D. | 凡是强酸和强碱反应的离子方程式都可以用H++OH-=H2O表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ”,其结构如红十字协会的会徽,因此有人将它称为“红十字烷”,写出它的分子式C12H24,当它发生一氯取代物时,能生成2种沸点不同的产物.
”,其结构如红十字协会的会徽,因此有人将它称为“红十字烷”,写出它的分子式C12H24,当它发生一氯取代物时,能生成2种沸点不同的产物.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H4和C5H6 | B. | 乙醇和二甲醚 | ||
| C. | 正丁烷和异戊烷 | D. | 一溴乙烷和二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
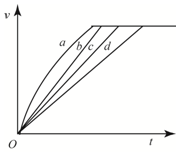 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实现条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实现条件,下列说法中一定不正确的是( )| 组别 | 对应曲线 | c(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第1组实验中盐酸的浓度大于2.5mol•L-1 | |
| B. | 第2组实验中盐酸的浓度大于2.5mol•L-1 | |
| C. | 第3组实验的反应温度低于30℃ | |
| D. | 第4组实验的反应速度最慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素仅存在于矿物中 | |
| B. | 金属元素存在于矿物和动物体內,但植物体內不含 | |
| C. | 少数金属元素以游离态存在,大多数金属元素以化合态存在 | |
| D. | 金属元素仅存在矿物中,动物和植物体內也不存在金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
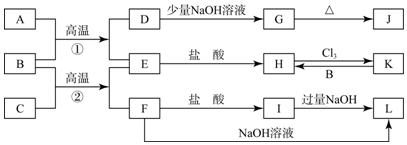
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com