
分析 (1)①容量瓶带有活塞,使用过程中需要上下颠倒摇动,使用前应检查是否漏水;
②不纯的可燃性气体燃烧容易发生爆炸;
(2)①依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
②需要480Ml0.1mol/L NaOH溶液,应选择500mL溶液的体积,依据m=CVM计算需要溶质的质量;
③NaOH溶解后未冷却至室温即进行定容,冷却后溶液体积偏小,依据c=$\frac{n}{V}$进行误差分析.
解答 解:(1)①容量瓶带有活塞,使用过程中需要上下颠倒摇动,使用前应检查是否漏水;
故答案为:检验容量瓶是否漏水;
②不纯的可燃性气体燃烧容易发生爆炸,所以点燃前应检气体纯度;
故答案为:检验气体纯度;
(2)①配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等,需要用到的仪器:托盘天平、药匙、玻璃棒、烧杯、容量瓶、胶头滴管;所以还缺少的仪器:玻璃棒 胶头滴管;
故答案为:玻璃棒、胶头滴管;
②需要480mL0.1mol/L NaOH溶液,应选择500mL溶液的体积,配制500mL溶液需要溶质的质量m=0.5L×0.1mol/L×40g/mol=2.0g;
故答案为:2.0;
③NaOH溶解后未冷却至室温即进行定容,冷却后溶液体积偏小,依据C=$\frac{n}{V}$,溶液浓度偏高;
故答案为:偏高.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格选择,题目难度不大.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:填空题
 (1)实验室用如图所示装置制备少量乙酸乙酯.
(1)实验室用如图所示装置制备少量乙酸乙酯.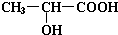 .试回答:
.试回答: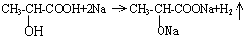 ;
;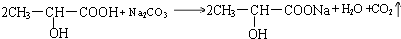 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
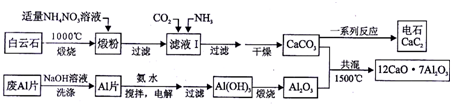
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化,通常表现为热量的变化 | |
| B. | 常温下氢氧化钡晶体与氯化铵晶体混合放出氨气,该反应为放热反应 | |
| C. | 酸碱反应生成1 mol水所发出的热量为中和热 | |
| D. | 旧化学键断裂所放出的能量高于新化学键形成所吸收的能量时发生放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 480mL容量瓶,7.68g硫酸铜 | B. | 480mL容量瓶,12.0g胆矾 | ||
| C. | 500mL容量瓶,12.5g硫酸铜 | D. | 500mL容量瓶,12.5g胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 000 mL容量瓶,58.5 g NaCl | B. | 980 mL容量瓶,57.3 g NaCl | ||
| C. | 500 mL容量瓶,58.5 gNaCl | D. | 1 000 mL容量瓶,117.0 g NaC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com