
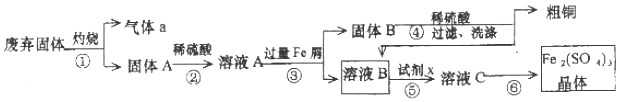
分析 废弃固体主要成分Cu2S和Fe2O3,灼烧废气固体发生反应Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$SO2+2CuO,所以气体a是SO2,固体A是CuO和Fe2O3,固体A和稀硫酸混合,发生的反应为CuO+H2SO4=CuSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,所以溶液A中成分为CuSO4、Fe2(SO4)3,向溶液A中加入过量Fe屑,发生反应CuSO4+Fe=FeSO4+Cu、2Fe2(SO4)3+Fe=3FeSO4,所以固体B成分是Fe、Cu,滤液B成分为FeSO4,固体B和稀硫酸混合,Fe和稀硫酸反应生成FeSO4,Cu和稀硫酸不反应,过滤得到固体粗铜;
向滤液B中加入试剂X得到溶液C,将溶液C浓缩结晶得到硫酸铁晶体,滤液B中成分是FeSO4,需要加入氧化剂双氧水将FeSO4氧化为硫酸铁,所以试剂x是H2O2;
(1)①固体灼烧用到容器坩埚;①灼烧操作和⑥溶液浓缩析出硫酸铁晶体中都用到的玻璃棒;
(2 )加入试剂x双氧水氧化亚铁离子,根据电荷守恒和得失电子守恒书写;
(3)通过重新滴加硫氰化钾溶液,证明该同学的假设是否合理.
解答 解:(1)①灼烧固体应该放在坩埚中,所以除酒精灯和铁架台(或三脚架)外,①中所需的容器为坩埚;①灼烧操作和⑥溶液浓缩析出硫酸铁晶体都用到玻璃棒,
故答案为:坩埚; 玻璃棒;
(2)由于加入试剂x双氧水目的是氧化亚铁离子,根据电荷守恒和得失电子守恒,反应离子方程式为:2Fe2++H2O2 +2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2 +2H+=2Fe3++2H2O;
(3)重新加入硫氰化钾溶液,若是溶液变红,说明该同学猜测合理,否则不合理,方法为:取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明乙同学的猜测是合理的,如不变红色,说明猜测不合理,
故答案为:取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明乙同学的猜测是合理的,如不变红色,说明猜测不合理(或滴加过量的0.1 mol•L-1 Fe2(SO4)3溶液,如溶液不变红色,说明合理,若变红色,说明猜测不合理).
点评 本题借助氯化铁固体的制取,考查了实验操作中仪器名称、试剂选择、硫酸铁溶液配制、检验方案的试剂、离子方程式书写等知识,题目综合性较强,充分考查了学生的分析、理解能力,本题难度中等.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 室温下,PH=2的溶液中:Fe2+、SO42-、Na+、NO3- | |
| C. | 无色透明的溶液中:NH4+、Cl-、NO3-、Fe3+ | |
| D. | 使红色石蕊试纸变蓝的溶液中:SO32-、Na+、CO32-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
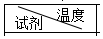 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
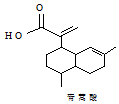
| A. | 青蒿酸的分子式为C15H20O2 | |
| B. | 1mol青蒿酸最多可与3molH2加成 | |
| C. | 青蒿酸与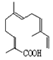 互为同分异构体 互为同分异构体 | |
| D. | 苯环上连有-CHO和-OH、分子中有6种不同化学环境氢的青蒿酸的同分异构体只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 反应物总能量小于生成物总能量 | |
| C. | 若在原电池中进行,反应放出的热量不变 | |
| D. | 升高温度,反应速率加快,但反应的△H不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com