
【题目】NO、SO2是大气污染物但又有着重要用途。
I.已知:N2 (g) + O2(g) = 2NO (g) ΔH1= 180.5kJ·mol1
C(s) + O2(g) = CO2(g) ΔH2 = 393.5kJ·mol1
2C(s) + O2(g) =2CO(g) ΔH3 =221.0kJ·mol1
(1)某反应的平衡常数表达式为K=![]() , 此反应的热化学方程式为:_________
, 此反应的热化学方程式为:_________
(2)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是_______(填序号)。
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该反应平衡常数保持不变
e.NO和CO的体积比保持不变
II.(3)SO2可用于制Na2S2O3。为探究某浓度的Na2S2O3的化学性质,某同学设计如下实验流程:

用离子方程式表示Na2S2O3溶液具有碱性的原因___________。Na2S2O3与氯水反应的离子方程式是__________。
(4)含SO2的烟气可用Na2SO3溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为_________________________(任写一个)。离子交换膜______(填标号)为阴离子交换膜。

(5)2SO3(g)![]() 2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp= _______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡,再向容器中加入等物质的量SO2和SO3,平衡将___________(填“向正反应方向”或“向逆反应方向” “不”) 移动。
2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp= _______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡,再向容器中加入等物质的量SO2和SO3,平衡将___________(填“向正反应方向”或“向逆反应方向” “不”) 移动。

【答案】 2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH =-746.5 kJ·mol1 acd S2O![]() +H2O
+H2O![]() HS2O
HS2O![]() +OH- S2O
+OH- S2O![]() +Cl2+5H2O=2 SO
+Cl2+5H2O=2 SO![]() +8Cl-+10H+ HSO
+8Cl-+10H+ HSO![]() +H2O-2e-=SO
+H2O-2e-=SO![]() +3H+或SO
+3H+或SO![]() +H2O-2e-=SO
+H2O-2e-=SO![]() +2H+ c
+2H+ c ![]() 向逆反应方向移动
向逆反应方向移动
【解析】分析:本题是化学反应原理的综合试题。几个小题之间互相没有关联,所以只需要对每个问题咨询分析计算即可。
详解:(1)根据反应的平衡常数的表达式得到反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),将第一和第三个方程式乘以-1,第二个方程式乘以2,相加得到:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH =-746.5 kJ·mol1。
N2(g)+2CO2(g),将第一和第三个方程式乘以-1,第二个方程式乘以2,相加得到:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH =-746.5 kJ·mol1。
(2)恒容下,压强不变就是气体的物质的量不变,该反应是气体物质的量减小的反应,所以压强不变可以证明平衡态,选项a正确。速率比应该等于方程式的系数比,所以v正(CO)= 2v逆(N2)才是正确说法,选项b错误。该反应中所有物质都是气体,所以m总不变,如果平均分子量不变,得到气体的n总不变(![]() ),该反应是气体物质的量减小的反应,所以n总不变是平衡态,选项c正确。平衡常数只与温度有关,平衡常数不变就是温度不变,该容器绝热,如果有吸热或者放热温度一定变化,现在温度不变,说明反应达平衡,既没有吸热也没有放热,选项d正确。开始冲入的NO和CO是相等的,反应中两者按照1:1进行反应,所以容器中两者恒定相等,选项e错误。
),该反应是气体物质的量减小的反应,所以n总不变是平衡态,选项c正确。平衡常数只与温度有关,平衡常数不变就是温度不变,该容器绝热,如果有吸热或者放热温度一定变化,现在温度不变,说明反应达平衡,既没有吸热也没有放热,选项d正确。开始冲入的NO和CO是相等的,反应中两者按照1:1进行反应,所以容器中两者恒定相等,选项e错误。
(3)Na2S2O3溶液显碱性的原因一定是硫代硫酸根离子水解,注意水解分步,方程式为:S2O![]() +H2O
+H2O![]() HS2O
HS2O![]() +OH-。根据反应过程的图示,加入氯化钡后得到的白色沉淀一定是硫酸钡,说明氯水将硫代硫酸根离子氧化为硫酸根离子,所以反应为:S2O
+OH-。根据反应过程的图示,加入氯化钡后得到的白色沉淀一定是硫酸钡,说明氯水将硫代硫酸根离子氧化为硫酸根离子,所以反应为:S2O![]() +Cl2+5H2O=2 SO
+Cl2+5H2O=2 SO![]() +8Cl-+10H+。
+8Cl-+10H+。
(4)用亚硫酸钠溶液吸收二氧化硫应该得到亚硫酸氢钠溶液,将亚硫酸氢钠溶液(pH=6的吸收液)加入电解槽中。右侧是电解的阴极,可以认是水电离的氢离子得电子转化为氢气,剩余的氢氧根离子与亚硫酸氢根离子反应得到亚硫酸根离子。左侧是电解的阳极,c为阴离子交换膜,亚硫酸氢根离子透过交换膜进入阳极,在阳极上失电子专户为硫酸根,副产物甲为硫酸。所以阳极反应为:HSO![]() +H2O-2e-=SO
+H2O-2e-=SO![]() +3H+或SO
+3H+或SO![]() +H2O-2e-=SO
+H2O-2e-=SO![]() +2H+(溶液中也有一定量的亚硫酸根)。
+2H+(溶液中也有一定量的亚硫酸根)。
(5)假设加入的SO3为2mol,平衡转化率为40%,所以反应的SO3为0.8mol,生成的SO2为0.8mol,O2为0.4mol,达平衡时有:1.2molSO3、0.8molSO2、0.4molO2;恒容下容器的压强比等于气体的物质的量的比,所以平衡时压强为:(1.2+0.8+0.4)P0/2=1.2P0。分压=总压×物质的量分数,所以SO3分压为:(1.2/2.4)×1.2P0=0.6P0;SO2分压为:(0.8/2.4)×1.2P0=0.4P0;O2分压为:(0.4/2.4)×1.2P0=0.2P0;所以KP=![]() 。题目要求判断再加入等物质的量SO2和SO3,平衡的移动方向,因为没有说明加入的量,所以是加入任意量应该得到相同结果,所以可以假设某确定值,带入进行计算。仍然按照上述计算,加入2molSO3平衡时有:1.2molSO3、0.8molSO2、0.4molO2。假设再加入SO2和SO3各自1.2mol,此时物质的量为:2.4molSO3、2molSO2、0.4molO2(一共4.8mol气体)。所以此时压强为4.8P0/2=2.4P0。SO3分压为:(2.4/4.8)×2.4P0=1.2P0;SO2分压为:(2/4.8)×2.4P0=P0;O2分压为:(0.4/4.8)×2.4P0=0.2P0;所以QP=
。题目要求判断再加入等物质的量SO2和SO3,平衡的移动方向,因为没有说明加入的量,所以是加入任意量应该得到相同结果,所以可以假设某确定值,带入进行计算。仍然按照上述计算,加入2molSO3平衡时有:1.2molSO3、0.8molSO2、0.4molO2。假设再加入SO2和SO3各自1.2mol,此时物质的量为:2.4molSO3、2molSO2、0.4molO2(一共4.8mol气体)。所以此时压强为4.8P0/2=2.4P0。SO3分压为:(2.4/4.8)×2.4P0=1.2P0;SO2分压为:(2/4.8)×2.4P0=P0;O2分压为:(0.4/4.8)×2.4P0=0.2P0;所以QP=![]() ,反应向逆反应方向移动。
,反应向逆反应方向移动。


科目:高中化学 来源: 题型:
【题目】工业上从含镍电镀废渣(除含镍外,还含有Cu、Zn、Fe等杂质)中制备NiCO3的工艺流程如下。

(1)“酸化”时需将电镀废渣粉碎并适当加热,原因是________________________。
(2)“氧化”时需要控制温度不超过40℃,其目的是________________________;“沉铁”后所得滤液中c(Fe3+)=____________mol·L-1[该温度下 Fe(OH))3的Ksp=2.64×10-39]。
(3)Fe2+也可以用NaCO3氧化,一定条件下可生成黄铁矾钠[Na2Fe6(SO4) 4(OH)12沉淀而被除去;如图是pH-温度关系图,图中阴影部分为黄铁矾钠稳定存在区域。

①FeOOH中铁的化合价是____________价。.
②酸性条件下,ClO3ˉ恰好氧化Fe2+时,氧化剂与还原剂物质的量之比是____________。
③根据上图,当T=120℃、pH=4时Fe元素的存在形式是____________(填化学式),该温度下,若要制得黄铁矾钠需控制pH范围____________(填字母选项)。
a.0~1 b.1~2.5 c.2.5~4
(4)已知SOCl2能与水反应生成SO2和HCl。写出NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制无水NCl2的化学方程式____________________________________。NCl2·6H2O需在亚硫酰氯(SOCl2)中加热脱水的原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=160mL时,则V2为

A.240mL B.300mL C.400mL D.440mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为98%的浓硫酸(ρ=1.84 g·cm-3)配制240 mL 1.84 mol·L-1稀硫酸,下列操作正确的是 ( )
A. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却
B. 必需的定量仪器有100 mL量筒、250 mL容量瓶
C. 量取浓硫酸的体积为25.0 mL
D. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验装置,下列说法不正确的是
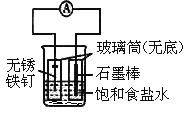
A. 装置为铁的吸氧腐蚀实验
B. 一段时间后,向插入石墨棒的玻璃筒内滴入石蕊试液,可观察到石墨附近的溶液变红
C. 一段时间后,向插入铁钉的玻璃筒内滴入NaOH溶液,即可观察到铁钉附近的溶液有沉淀出现
D. 若将装置中饱和食盐水换成稀硫酸,装置为析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作不能达到相应目的的是( )
|
|
|
|
A.干燥Cl2 | B.分离汽油与食盐溶液 | C.实验室制取少量蒸馏水 | D.比较Na2CO3与NaHCO3的稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是

A. 图Ⅰ所示电池中,MnO2是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池工作过程中,电子由Zn极流向Ag2O极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上采用氨的催化氧化法制备硝酸。
(1) 已知反应N2(g)+3H2(g) 2NH3(g)为放热反应,在恒容容器中能说明该反应达到平衡状态的是(_______)
A.容器内N2、H2、NH3的浓度之比为1:2:3
B. v正(N2)=v逆(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
(2)理论上,为了增大平衡时的转化率,可采取的措施是_____________(要求答出两点)
⑶合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下表,则400℃时,测得某时刻氮气、氢气、氨气的物质的量浓度分别为1 mol·L-1、2 mol·L-1、3 mol·L-1时,此时刻该反应正反应速率_____ 逆反应速率(填“大于”、“小于”或“等于”)
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
(4)消除硝酸工厂尾气的一种方法是用甲烷催化还原氮氧化物,已知:
① CH4 (g)+2O2(g)=CO2(g)+2H2O(g) △ H=-890.3 kJ·mol-1
② N2(g)+2O2(g)=2NO2(g) △ H=-67.0 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为___________________________________________
(5)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____沉淀(填化学式),当两种沉淀共存时,溶液中C(Mg2+)/C(Cu2+)=_________(已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com