
【题目】向一定体积 CaCl2 和 HCl 的混合溶液中逐滴加入浓度为 1.00mol·L-1 的 Na2CO3溶液,反应过程中加入的 Na2CO3 溶液的体积与产生沉淀或气体的质量关系如图所示。
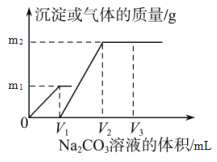
已知:图中 V1: V2=1:2,当加入 V2mLNa2CO3 溶液时,所得溶液的浓度为 1.00 mol·L-1,体积为 200mL。求:
(1)混合溶液中 CaCl2和 HCl 物质的量之比n(CaCl2)∶n(HCl)=_______。
(2)m2=______g。
【答案】 1:2 5.00
【解析】试题分析:由图像可知,向一定体积 CaCl2 和 HCl 的混合溶液中逐滴加入浓度为 1.00mol·L-1 的 Na2CO3溶液,0~V1发生的是碳酸钠与盐酸反应,生成二氧化碳的质量为m1,V1~V2发生的是碳酸钠与氯化钙的反应,生成碳酸钙的质量为m2。又知V1:V2=1:2,说明盐酸和氯化钙消耗的Na2CO3 溶液体积相等,由两个反应的化学方程式可知,n(CaCl2)∶n(HCl)= 1:2;当加入 V2mLNa2CO3 溶液时,所得溶液为氯化钠溶液,其浓度为 1.00 mol·L-1,体积为 200mL,所以n(NaCl)=0.200mol,由氯离子守恒可以求出n(CaCl2)=0.0500mol、n(HCl)=0.100mol。
(1)混合溶液中 CaCl2和 HCl 物质的量之比n(CaCl2)∶n(HCl)= 1:2。
(2)由钙离子守恒可知,n(CaCO3)=n(CaCl2)=0.0500mol,所以m2=0.0500mol![]() 5.00g。
5.00g。


科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=-1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H=+57.3 kJ/mol(中和热)
C. S(s)+O2(g) =SO2(g) △H=-296.8 kJ/mol(反应热)
D. 2NO2=O2+2NO △H=+116.2 kJ/mol(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),得电子能力最强的原子是______,失电子能力最强的单质与水反应的化学方程式是___________________,常温下单质为液态的非金属单质是____________。
(2)元素④的离子结构示意图为__________________。
(3)⑥⑦⑧气态氢化物的化学式分别为________、________、________,其中以
(4)写出③的单质置换出⑥的单质的化学方程式:__________________。
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为_____________。
②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为_____________。
②的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语作答
(1)书写电子式:H2____________N2_________CH4_________NaOH_________
(2)用电子式表示物质的形成过程
MgCl2_______________________________________
H2O_______________________________________
(3)两种含10电子的粒子反应生成两种10电子的粒子的离子方程式______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。在基态14C原子中,核外存在___________对自旋相反的电子。
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为__________________________。
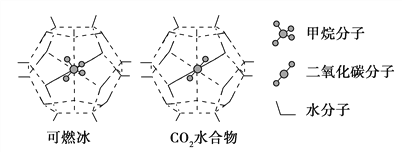
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①下列关于CH4和CO2的说法正确的是________(填序号)。
a.CO2分子中含有2个σ键和2个π键
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586 nm,根据上述图表所提供的数据分析,提出该设想的依据是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列四个反应:
①2Na+2H2O===2NaOH+H2↑
②2F2+2H2O===4HF+O2
③Cl2+H2O===HCl+HClO
④C+H2O(g) ![]() CO+H2
CO+H2
试从氧化还原的角度,回答下列问题:
(1)水只作氧化剂的是________;
(2)水只作还原剂的是________;
(3)水既不作氧化剂又不作还原剂的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,两种酸的电离常数如下右表。下列说法正确的是
酸 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-6 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
A. H2CO3的电离方程式为H2CO3![]() 2H++CO
2H++CO![]()
B. 酸性强弱顺序为H2SO3>H2CO3>HSO>HCO
C. 0.2 mol/L Na2CO3溶液中离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)>c(H+)
)>c(HCO)>c(OH-)>c(H+)
D. 足量SO2气体通入NaHCO3溶液中,反应的离子方程式为SO2+HCO==HSO+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与其主要成分的化学式不相对应的是
A. 明矾一KA1(SO4)2·12H2O B. 铝热剂一A1 C. 纯碱一Na2CO3 D. 石英—SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是
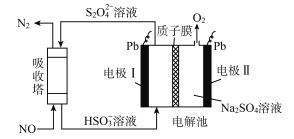
A. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2
B. 电解池中质子从电极I向电极Ⅱ作定向移动
C. 吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3-
D. 每处理1 mol NO电解池质量减少16g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com