
分析 I(1)到达平衡后,生成amolC,由反应可知,转化的A为amol;
(2)到达平衡后,A和C的物质的量分别是ymol和3amol,由物质的量与压强成正比可知,极性转化后A、B的起始量相同;
(3)若在(2)的平衡混合物中再加入3molC,与上述平衡为等效平衡,物质的量分数不变;
II(4)开始时放入1molA和1molB到达平衡后生成bmolC,体积不变时,发生反应气体的物质的量减小,压强减小,则平衡逆向移动.
解答 解:(1)到达平衡后,生成amolC,则
A(气)+B(气)?C(气)
起始量(mol) 1 1 0
变化量(mol) a a a
平衡量(mol) 1-a 1-a a
A的物质的量为(1-a)mol,
故答案为:(1-a);
(2)恒温、恒压下到达平衡后,C的物质的量为3amol,说明和(2)所达到的平衡是相同的平衡,满足A、B起始量分为3mol、3mol,假设反应正向进行,则
A(气)+B(气)?C(气)
起始量(mol) x 2 1
变化量(mol) 3a-1 3a-1 3a-1
平衡量 (mol) y 3-3a 3a
依据等效平衡,y=3-3a,x=2,
故答案为:2;3-3a;
(3)若在(2)的平衡混合物中再加入3molC,与上述平衡为等效平衡,物质的量分数不变,则再次到达平衡后,C的物质的量分数是$\frac{a}{1-a+1-a+a}$=$\frac{a}{2-a}$,
故答案为:$\frac{a}{2-a}$;
II(4)开始时放入1molA和1molB到达平衡后生成bmolC,体积不变时,发生反应气体的物质的量减小,压强减小,则平衡逆向移动,则b小于a,
故答案为:(乙).
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、等效平衡及平衡移动为解答的关键,侧重分析与计算能力的考查,注意等效平衡的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | c1=2c2 | B. | c2=2cl | C. | c2>2c1 | D. | c2<2cl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
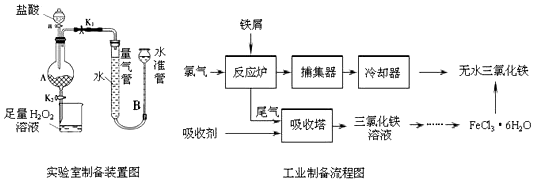
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | CO2 |
| H2O | CO | ||||
| 1 | 650 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | 2 | 0.4 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
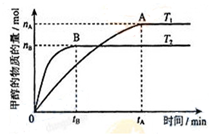 甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下
甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
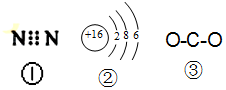
| A. | 图中的①是N2的电子式 | |
| B. | 图中的②是S2-的结构示意图 | |
| C. | 质子数为53,中子数为78的碘原子:13153I | |
| D. | 图 ③为CO2的结构式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碳酸钙的状态 | 盐酸的浓度 | 反应的温度 | |
| A. | 块状 | 1 mol/L | 25℃ |
| B. | 块状 | 6 mol/L | 40℃ |
| C. | 粉末 | 1 mol/L | 25℃ |
| D. | 粉末 | 6 mol/L | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com