
【题目】下列指定反应的离子方程式正确的是( )
A.FeCl3溶液中加入铜粉:2Fe3++3Cu=2Fe+3Cu2+
B.Al2O3溶于烧碱溶液:2Al3++3O2-+2OH-=2AlO![]() +H2O
+H2O
C.Al(OH)3溶于稀硫酸:Al(OH)3+3H+=Al3++3H2O
D.氢氧化钡溶液与硫酸溶液反应:Ba2++SO![]() =BaSO4↓
=BaSO4↓
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是
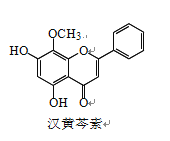
A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论不一致的是( )
选项 | 实验操作 | 实验目的或结论 |
A、 |
| 通过观察液面差判断该装置的气密性 |
B、 | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
C、 | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗涤的沉淀中加稀盐酸,有气泡产生 | 说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
D、 | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 不能检验制得气体是否为乙烯 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】EHPB是合成治疗高血压和充血性心力衰竭的药物的中间体,合成路线如下:

已知:ⅰ、碳碳双键容易被氧化
ii、 +CH3COOH
+CH3COOH
(1)A的名称是_____,A形成的顺丁橡胶的结构式是_____.
(2)已知1molE发生银镜反应可生成4molAg.E中含氧官能团的名称为_____.
(3)E由B经①、②、③合成.
a.①的反应试剂和条件是_____.
b.②、③的反应类型依次是_____、_____.
(4)1molF转化成G所消耗的NaOH的物质的量为_____mol.
(5)M的结构简式为_____.
(6)完成下列化学方程式:
①EHPB不能与NaHCO3反应,有机物N→EHPB的化学方程式为_____.
②有机物K与试剂x发生反应的化学方程式为_____.
(7)有机物N有多种同分异构体,写出一种满足下列条件的同分异构体的结构简式_____.
a.含有酚羟基 b.能水解又能发生银镜反应
c.苯环上的一氯代物只有一种 d.核磁共振氢谱有5组峰.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组利用易拉罐(主要成分是Al、Fe)制备明矾的过程如下图所示:
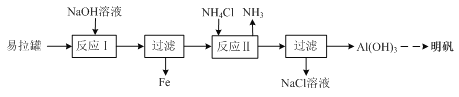
⑴ 写出“反应Ⅰ”时的离子反应方程式:________。
⑵ 写出“反应Ⅱ”时的化学反应方程式:________。
⑶ 过滤所得Al(OH)3需进行洗涤,检验Al(OH)3已洗涤干净的方法是:________。
⑷ 明矾能够净水的原因是________。
⑸ Fe和水蒸气在高温下反应后所得固体产物X可用于制取FeCl2溶液。请从下列试剂中选择合适的将X转化为FeCl2溶液。试剂:盐酸、NaCl溶液、Cu粉、Fe粉。依次选用的试剂为:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻质碳酸镁[主要含MgCO3和Mg(OH)2]是制取氧化镁的工业原料。某研究性学习小组用如图所示装置确定轻质碳酸镁的组成。向广口瓶B中加入足量1.00 mol·L-1稀硫酸,充分反应后测得D装置增重0.88 g;向B所得溶液中加入足量NaOH溶液,过滤,将所得沉淀洗涤、低温干燥、称量所得Mg(OH)2固体为1.45 g。

⑴ 反应后需向装置A中缓缓鼓入空气,目的是________。
⑵ 某同学旋转分液漏斗下面的活塞,发现液体不能顺利流下,可能的原因是________。
⑶ 由浓硫酸配制100mL 1.00 mol·L-1的硫酸,下列操作会使所配溶液浓度偏低的是________填字母)。
A.容量瓶使用前未干燥,有少量水残留
B.定容时,俯视容量瓶刻度线
C.加水时超过刻度线,用胶头滴管吸出多余的液体
D.稀释浓硫酸时未冷却至室温就将溶液转移入容量瓶
⑷ 该轻质碳酸镁中MgCO3和Mg(OH)2物质的量的比值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.物质的量是研究物质所含微粒集体的多少,单位为mol
B.物质的量把微观粒子数目与宏观物质的质量联系起来
C.1molNaCl晶体中含有NA个NaCl分子
D.12gC-12中所含的原子数为阿伏加德罗常数,NA近似为6.02×1023mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应mA(s)+nB(g)![]() eC(g)+f D(g),当其它条件不变,平衡时C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
eC(g)+f D(g),当其它条件不变,平衡时C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
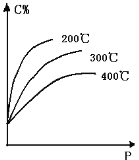
A. 化学方程式中n<e+f
B. 达到平衡后,加入催化剂,则C%增大
C. 达到平衡后,若升温,平衡逆向移动
D. 达到平衡后,增加A的量,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸
分子式:HCl
相对分子质量:36.5
密度约1.18gmL-1
HCl的质量分数:36.5%
(1)该盐酸的物质的量浓度为_________ mol·L-1。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中c(HCl)=_____mol·L-1。
(3)取稀释后的适量盐酸与足量的锌粒作用,生成0.25 mol氢气,在标准状况下气体的体积____ L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com