
����Ŀ��(NH4)2Fe(SO4)2![]() 6H2O��M��392g
6H2O��M��392g![]() mol��1���ֳ�Ī���Σ����FAS����������Դ�ڵ¹���ѧ��Ī����Karl Friedrich Mohr��������dz����ɫ�ᾧ���ĩ���Թ����У��ڿ����л��绯��������������ˮ�������������Ҵ���ijʵ��С�����ù�ҵ����м��ȡĪ���Σ����ⶨ�䴿�ȡ�
mol��1���ֳ�Ī���Σ����FAS����������Դ�ڵ¹���ѧ��Ī����Karl Friedrich Mohr��������dz����ɫ�ᾧ���ĩ���Թ����У��ڿ����л��绯��������������ˮ�������������Ҵ���ijʵ��С�����ù�ҵ����м��ȡĪ���Σ����ⶨ�䴿�ȡ�
����Ī���ε���ȡ
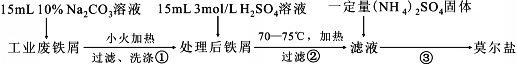
�ش��������⣺
��1������ڱ�����ʣ��������мʱ���й��ˣ���ԭ���� ���������ӷ���ʽ��ʾ��
��2����ȡ��Ī�������Ҫ�� ϴ�ӣ�����ĸ��ţ�����Ŀ���ǣ� ��
a������ˮ b���Ҵ� c����Һ
��3������ͼ��ѡȡ�����õ��������ӳ�ʵ������ȡ(NH4)2SO4��Һ��װ�ã����ӵ�˳���ýӿ���ĸ��ʾ����_____________��
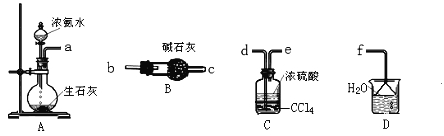
����FAS���Ȳⶨ
Ϊ�ⶨFAS���ȣ�ȡm g��Ʒ���Ƴ�500 mL��Һ������������ɣ��ס�����λͬѧ�������������ʵ�鷽����
��1��������ȡ20.00 mLFAS��Һ����0.1000 mol��L��1 ������K2Cr2O7 ��Һ���еζ���
i��д���˷�Ӧ�����ӷ���ʽ�� ��
ii) �ζ�ʱ����ѡ�õ������� ��
��2���ҷ�����ȡ20.00 mLFAS��Һ��������ʵ�顣
![]()
�г�����FAS���崿�ȵĴ���ʽ �����ü�����������
��3����֪ʵ���������ȷ��ȴ���ּ����IJⶨ�������С���ҷ���������ܵ�ԭ���� ����ƼĻ�ѧʵ����֤�����Ʋ� ��
���𰸡���1��Fe + 2Fe3+=3Fe2+
��2��b ����ȥ�������ˮ�֣����پ���ĸ����ֹ����������
��3��a��d��e��f��a��d��e��f��a��d��e��f
��1��i)6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
ii)�٢ܢݢ�
��2��392��25W/2��233m��100% ��196��25W/233m��100%
��3��Fe2+����������������ȡ����FAS��Һ����������KSCN��Һ������Һ��Ϊ��ɫ��˵��Fe2+����������������
��������
�����������1��Fe2+���н�ǿ�Ļ�ԭ�Ժ����ױ�����������Ϊ�˷�ֹ��Fe3+���ɣ���Ӧԭ��Ϊ��Fe + 2Fe3+=3Fe2+������ڱ�����ʣ��������мʱ���й�����
�ʴ�Ϊ��Fe + 2Fe3+=3Fe2+��
��2����ȡ��Ī�������Ҫ���Ҵ�ϴ����Ŀ���������Ҵ���ˮ�������ӷ����ص���ȥ�������ˮ�֣����پ���ĸ����ֹ������������
�ʴ�Ϊ��b����ȥ�������ˮ�֣����پ���ĸ����ֹ������������
��3����װ��A��ȡ�İ���ͨ��Ũ�����з�����Ӧ����(NH4)2SO4��Һ��Ϊ�˷�ֹ��Ⱦ�����������Dװ�����հ��������ԣ����������ӵ�˳����a��d��e��f��
�ʴ�Ϊ��a��d��e��f��a��d��e��f��a��d��e��f��
��1��i) (NH4)2SO4������K2Cr2O7 ��Һ����������ԭ��Ӧ��6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O��
�ʴ�Ϊ��6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O��
ii)��Ϊ(NH4)2SO4������K2Cr2O7 ��Һ�������ü�ʽ�ζ��ܣ������ζ�ʱ����ѡ�õ��������٢ܢݢ���
�ʴ�Ϊ���٢ܢݢ���
��2��Wg����ΪBaSO4�����������غ��֪mg��Ʒ�к�(NH4)2SO4������Ϊ��392��25W/2��233g������Ʒ�Ĵ���Ϊ��392��25W/2��233m��100% =196��25W/233m��100%��
�ʴ�Ϊ��392��25W/2��233m��100% ��196��25W/233m��100%��
��3����֪ʵ���������ȷ��ȴ���ּ����IJⶨ�������С���ҷ���������ܵ�ԭ����Fe2+����������������ȡ����FAS��Һ����������KSCN��Һ������Һ��Ϊ��ɫ��˵��Fe2+������������������
�ʴ�Ϊ��Fe2+����������������ȡ����FAS��Һ����������KSCN��Һ������Һ��Ϊ��ɫ��˵��Fe2+������������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaNO2����һ�ֳ�����ʳƷ���Ӽ���ʹ��ʱ�����ϸ������������ij��ȤС���������ʵ��̽������������֪������2NO+Na2O2=2NaNO2 ��2NO2+Na2O2=2NaNO3������KMnO4��Һ�ɽ�NO2������ΪNO3����MnO4����ԭ��Mn2+��
��Ʒ�Ʊ�����飺����ͼ1װ���Ʊ�NaNO2��
��1��д��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽ���������ת�Ƶķ������Ŀ__________
��2��Bװ�õ�������_______
��3����ͬѧ��Ϊװ��C�в��ﲻ�����������ƣ����������ơ�̼���ơ��������ƣ�Ϊ�Ʊ�����NaNO2Ӧ��B��Cװ�ü�����һ��װ�ã������ҿ��ڻ������ӵ�װ��ͼ2��������ʢ�ŵ��Լ���
��4�������ʵ�����װ��C��NaNO2�Ĵ��ڣ�д������������ͽ��ۣ�_____________________
�����IJⶨ
��ȡװ��C�з�Ӧ��Ĺ���4.00g����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
![]()
��5����һ��ʵ�����ݳ����쳣����������쳣��ԭ�������________��˫��ѡ��
A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
B����ƿϴ����δ����
C���ζ��������Ӷ���
D���ζ��������Ӷ���
��6�����ݱ������ݣ��������ù������������Ƶ���������________���������4λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷���FeSO4��7H2O��������ȱ����ƶѪҩƷ����Ҫ�ɷ֡���������������м��������������������������Ϊԭ�����������̷���һ�ַ�����
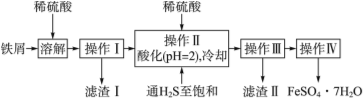
��ѯ���ϣ����й����ʵ�������������
25 ��ʱ | pH[] |
����H2S��Һ | 3.9 |
SnS������ȫ | 1.6 |
FeS��ʼ���� | 3.0 |
FeS������ȫ | 5.5 |
��1���������У�ͨ�����������͵�Ŀ����_______������Һ���������ữ��pH��2��Ŀ����________��
��2�����������Ҫ�ɷ���__________��
��3���������õ����̷�������������ˮϴ�ӣ���Ŀ���ǣ�
�ٳ�ȥ������渽�ŵ���������ʣ���_____________________________��
��4���ⶨ�̷���Ʒ��Fe2�������ķ����ǣ�a����ȡ2.850 g�̷���Ʒ���ܽ⣬��250 mL����ƿ�ж��ݣ�b����ȡ25.00 mL������Һ����ƿ�У�c���������ữ��0.010 00 mol��L��1 KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00 mL��
�ٵζ�ʱʢ��KMnO4��Һ������Ϊ__________����������������
���жϴ˵ζ�ʵ��ﵽ�յ�ķ�����____________________________��
�ۼ���������Ʒ��FeSO4��7H2O����������Ϊ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ɱ�(A)��һ���µĿ��������֢ҩ����ɻ�����B��C��D���л��ܼ���ͨ����������·�ߺϳɵõ���

��1�� E�Ľṹ��ʽΪ ���京���������� ��д����)��
��2����C, D���ɻ�����F�ķ�Ӧ������ ��������C��������NaOH�Ҵ���Һ���ȷ�Ӧ�IJ���������� ��
��3��H���ڰ����ᣬ��B��ˮ����ﻥΪͬ���칹�塣H����FeCl3��Һ������ɫ��Ӧ���ұ����ϵ�һ�ȴ���ֻ��2�֡�д��������������������H�Ľṹ��ʽ�� �� ��
��4���ϳ�F����Է�������Ϊ366��ʱ����������һ����Է�������Ϊ285�ĸ�����G��G��ʹ��ˮ��ɫ��G�Ľṹ��ʽΪ ��
��5����֪�� д����C�Ʊ�������
д����C�Ʊ�������
�ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��25��ʱ���ڵ������ �� pH��0��H2SO4��Һ���� 0.05 mol/L��Ba (OH)2��Һ���� pH��10��Na2S��Һ���� pH��5��NH4NO3��Һ�У����������ˮ�����ʵ���֮�� ��
��2�������£�0.2mol/LCH3COOH��Һ��0.1mol/LNaOH��Һ�������Ϻ���
c(CH3COO) + c(CH3COOH)= mol/L
c(H+) c(CH3COO) - c(CH3COOH) +2c(OH) ����������������������������
��3������������pH=11������������Һ��pH=3�Ĵ�����Һ������������������Һ������Ũ�ȴ�С��ϵ�� ��
��4�������£���pH=2��H2SO4��pH=11��NaOH��Һ��������ҺpH=7��������Һ��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ҹ�������������ŷŵķ�����ʯ����ȡ���Ტ����ˮ��ļ����о���óɹ�����֪��ʯ����Ҫ�ɷ���Ca3��PO4��2����������������ͼ��

�ش��������⣺
��1��װ��a����������NH3�����ù�����ʵ�����н��У��뻭��װ��a��ʾ��ͼ��_____��
��2���Ƚ�������ʵ�����Ƚ�����װ�á���ѧʵ����Ҳ���������Ƚ�����ʵ��ij��ʵ��Ŀ�ģ�������Һ�Ƚ���ʱͨ��ʹ�õ�������_______________��
��3��������²����A��һ�����е����ʵĻ�ѧʽ��___________���ᾧˮ���ֲ�д����
��4��������������ŷŵķ�����ʯ����ȡ���ᣬ����SO2��������Ĺ�������ͼ��ͼ��ʾ��

����A�������������������������豸A��������___________���豸A�з�����Ӧ�Ļ�ѧ����ʽ��______________��Ϊ�����������IJ��ʣ��ô�Ӧ����_____������¹��̡����ȹ��̡���Ϊ�ˡ�
����D�����ж��δ�������ԭ����_______________________��
��B������������Ҫ�ǵ�������������ʱ���徭��C����������D����Ϊ��___________��
��20%�ķ������ᣨSO3����������Ϊ20%��1�����ˮ_______�֣�����2λ��Ч���֣��������Ƴ�98%�ij�Ʒ���ᡣ
��5����������������β�����˺���N2��O2�⣬������SO2������SO3�������������ڲⶨ����β����SO2��������___________________��
A��NaOH��Һ����̪��Һ B��KMnO4��Һ��ϡ����
C����ˮ��������Һ D����ˮ����̪��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ���ش��������⣺
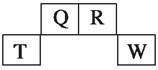
��1��TԪ�ص����ӽṹʾ��ͼΪ__________��
��2��Ԫ�صķǽ�����(ԭ�ӵõ��ӵ�����)��Q ________W(����ǿ��������������)��
��3��W�ĵ�����������������ˮ����Ũ��Һ�����ܷ�����Ӧ�������������ʣ�����һ�������壬�÷�Ӧ�Ļ�ѧ����ʽΪ_________________________________________
��4��ԭ��������R��1��Ԫ�ص�һ���⻯���ֽܷ�Ϊ������һ���⻯��˷ֽⷴӦ�Ļ�ѧ����ʽ��_________________________________________________________�䷴Ӧ��ĵ���ʽΪ �����Ӱ뾶T3+__________R3-����������������������������
��5��R�ж�����������м���Է���������С����һ�������£�2 L�ļ�������0.5 L���������ϣ����û�����屻������NaOH��Һ��ȫ���պ�û����������������ɵ�R�ĺ�������ֻ��һ�֣���ú������εĻ�ѧʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����~��ʮ��Ԫ�أ���Ԫ�����ڱ��е�λ����ͼ��ʾ���ش��������⣺
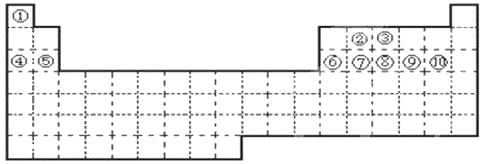
��1��������ʮ��Ԫ���У��û��������������ǿ��Ԫ��Ϊ ���ѧ���ţ���ͬ��������������ˮ�����������ǿ�Ļ�����Ļ�ѧʽ�� ��������ǿ�Ļ�����Ļ�ѧʽ�� �������Ե���������Ļ�ѧʽ�� ��ԭ�Ӱ뾶����Ԫ���� ���뾶��С�������� ��
��2������ʮ��Ԫ���У���������ǿ��Ԫ�������ڱ��е�λ���ǵ� ���� �壬��Ԫ�صĵ����ڿ�����ȼ�յĻ�ѧ����ʽΪ ��
��3�����õ���ʽ��ʾԪ���������γɷ��ӵĹ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�����Ա������б��Ϊ��������Ԫ�ػش��������⡣
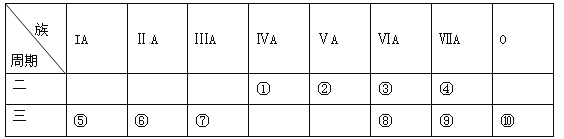
��1���ǽ�������ǿ��Ԫ����______(��Ԫ�ط��ţ���ͬ)���γɻ�������������Ԫ����____________��
��2����������Ԫ�س�����ԭ�Ӱ뾶��С����______(��Ԫ�ط���)����ЩԪ�ص�����������Ӧˮ�����м�����ǿ����__________(�ѧʽ����ͬ)���������Ե���____________��
��3���ݢޢ����ʵĻ�����˳��Ϊ______��______��______(��Ԫ�ط���)���жϵ�ʵ��������_______(д��һ��)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com