
分析 根据有机物燃烧时,有机物中的碳全部转化为二氧化碳,其质量可以根据碱石灰的质量增加量来确定,有机物中的氢全部转化为水,其质量可以根据浓硫酸质量增加来确定,烯烃和溴单质能发生加成反应,溴水质量增加量就是烯烃的质量,然后分别设出烷烃、烯烃的分子式、物质的量,根据烯烃质量、混合烃总物质的量、H原子守恒、C原子守恒列式计算即可.
解答 解:(1)混合气体的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,燃烧后通过浓H2SO4,增重的质量即水的质量为4.05g,则水的物质的量为:$\frac{4.05g}{18g/mol}$=0.225mol,再通过碱石灰,增重的质量即生成CO2的质量为6.60g,二氧化碳的物质的量为:$\frac{6.60g}{44g/mol}$=0.15mol;
另取0.1mol混合物通入溴水,增重的质量即烯烃的质量为1.05g,可设烷烃、烯烃分别为CxH2x+2、CyH2y,且两种烃的物质的量分别为a,b,则有:1.05g=14yg/mol×b;a+b=0.1mol;(2x+2)a+2yb=0.225mol×2((H守恒);ax+by=0.15mol(C守恒),解得:x=1,y=3,a=0.075mol,b=0.025mol,所以烷烃为CH4,单烯烃为丙烯C3H6,
答:混合气体由CH4、C3H6组成;
(2)相同条件下气体的体积之比等于其物质的量之比,则CH4的体积分数为:$\frac{0.075mol}{0.075mol+0.025mol}$×100%=75%;
C3H6的体积分数为:1-75%=25%,
答:CH4、C3H6的体积分数分别为75%、25%.
点评 本题考查了有机物分子式确定的计算,题目难度中等,明确浓硫酸、碱石灰、溴水质量变化的实质为解答关键,注意掌握质量守恒定律在化学计算中的应用方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
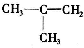 、CH3CH=CHCH3和CH3CH2CH=CH2.
、CH3CH=CHCH3和CH3CH2CH=CH2. ,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.
,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①② | C. | ③⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

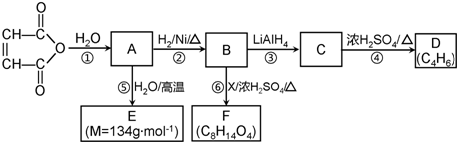

 C2H5OOCCH2CH2COOC2H5+2H2O.
C2H5OOCCH2CH2COOC2H5+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水$\stackrel{NaOH}{→}$Mg(OH)2$\stackrel{电解}{→}$Mg | |
| B. | 海水$\stackrel{HCl}{→}$MgCl2溶液→MgCl2(熔融)$\stackrel{电解}{→}$Mg | |
| C. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | 海水$\stackrel{石灰乳}{→}$ Mg(OH)2$\stackrel{BCl}{→}$ MgCl2溶液→MgCl2(熔融)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子 | A+ | B2- | C | D | E | F |
| 组成特点 | 单核离子 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
 .
.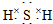 ;F的水溶液常用于消毒剂,F的化学式是H2O2.
;F的水溶液常用于消毒剂,F的化学式是H2O2.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
族 周期 | ||||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com