
 回答下列问题
回答下列问题分析 由图A可知,P2较先达到平衡状态,则P2>P1,压强越大,A的转化率越低,说明增大压强平衡向逆方向移动;由图B可知t1先达到平衡状态,则t1>t2,升高温度平衡向正反应方向移动,以此解答该题.
解答 解:①由图A可知,P2较先达到平衡状态,则P2>P1,
故答案为:小;
②P2>P1,压强越大,A的转化率越低,说明增大压强平衡向逆方向移动,则(a+b)比(c+d)小,
故答案为:小;
③由图B可知t1先达到平衡状态,则t1>t2,
故答案为:高;
④t1>t2,升高温度平衡向正反应方向移动,说明正反应吸热,则Q>0,
故答案为:正.
点评 本题考查化学平衡与图象问题,侧重于学生的分析能力的考查,为高考常见题型,题目难度中等,注意把握图象曲线的变化趋势,结合温度、压强对平衡移动的影响分析.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 尼古丁中C、H、N三种元素的质量比为5:7:1 | |
| B. | 吸烟有害健康 | |
| C. | CO比O2更易同血红蛋白结合,会导致人体缺氧 | |
| D. | 尼古丁中氮元素的质量分数约为17.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N | B. | O | C. | Na | D. | S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H2、HCN都是含有极性键的非极性分子 | |
| B. | CO2与SO2的空间构型相似,都是非极性分子 | |
| C. | HC≡C一CH(CH3)-CH=CH一CH3分子中含有1个手性碳原子 | |
| D. | 无机含氧酸分子中有几个氢原子,它就属于几元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
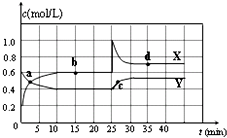 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )| A. | 图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | |
| B. | 前10 min内用v(N2O4)表示的化学反应速率为0.2 mol/(L•min) | |
| C. | 25 min时,NO2转变为N2O4的反应速率增大,不可能是将密闭容器的体积缩小为1L引起的 | |
| D. | 前10 min内用v(NO2)表示的化学反应速率为0.04 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36 | B. | 49 | C. | 48 | D. | 64 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该过程中CeO2没有消耗 | |
| B. | 该过程实现了太阳能向化学能的转化 | |
| C. | 如图中△H1=△H2+△H3 | |
| D. | 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-═CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室可用浓硫酸和亚硫酸钠固体制备SO2,并验证其相关性质.装置如图所示
实验室可用浓硫酸和亚硫酸钠固体制备SO2,并验证其相关性质.装置如图所示查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com