
【题目】常温下,0.1 mol·L-1的一元酸HA与0.1 mol·L-1的NaOH溶液等体积混合后,所得溶液pH>7,下列说法正确的是
A.混合前一元酸HA的c(H+)=0.1 mol·L-1
B.该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.HA在水溶液中的电离方程式:HA = H+ + A-
D.该混合溶液中:c(A-)+ c(HA)=0.1 mol·L-1
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A. pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等
B. 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C. 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2、④NH3H2O三种溶液中NH4+的浓度:②>③>①>④
D. 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后
【答案】C
【解析】A、Ba(OH)2为强碱,抑制水的电离,Na2C03为强碱弱酸盐,CO32-结合水中的H+,从而促进水的电离,因此Na2C03溶液中水电离的c(OH)大,故A错误;B、溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-),所以c(Na+)=c(Cl-)+c(CH3COO-),c(Na+)>c(Cl-),根据醋酸钠的物料守恒得c(Na+)=c(CH3COO-)+c(CH3COOH),所以(Cl-)=c(CH3COOH),c(Na+)>c(Cl-)=c(CH3COOH),故B错误;D、①NH4HCO3中NH4+水解呈酸性,HCO3水解呈碱性,促进NH4+的水解;②NH4HSO4在水溶液中完全电离出H+,抑制NH4+的水解;③NH4Fe(SO4)2中,Fe3+水解呈酸性,但Fe3+水解产生H+的浓度小,它对抑制NH4+的水解抑制程度小;④NH3H2O部分电离,产生的NH4+浓度比盐溶液中的小,故四种溶液中NH4+的浓度:②>③>①>④,故C正确;D、根据电荷守恒NaClO(aq)中c(Na+)+c(H+)=c(OH)+c(ClO),所以NaClO(aq)中离子总浓度为2[c(Na+)+c(H+)];根据电荷守恒NaCl(aq)中离子总浓度也为2[c(Na+)+c(H+)];等浓度的NaClO(aq)与NaCl(aq)中c(Na+)相同,NaClO溶液中ClO-水解,溶液呈碱性,c(OH)>c(H+),c(H+)<![]() ,而NaCl(aq)中,c(OH)=c(H+)=
,而NaCl(aq)中,c(OH)=c(H+)=![]() ,所以NaClO(aq)中c(H+)小于NaCl(aq)中c(H+),所以等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后,故D错误。故选C。
,所以NaClO(aq)中c(H+)小于NaCl(aq)中c(H+),所以等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后,故D错误。故选C。
【题型】单选题
【结束】
17
【题目】常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.放热反应的发生均无需加热
B.需要加热后才能发生的反应均是吸热反应
C.伴有能量变化的物质变化都是化学变化
D.物质发生化学反应都伴随着能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。
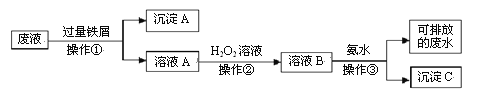
(1)操作①的名称是_____。
(2)沉淀A中含有的金属单质有__________。
(3)操作②中观察到的实验现象是_____________。
(4)检验溶液B中含有的金属阳离子常用的试剂是___________。
(5)操作③中发生反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是

A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42-)+ c(H+)= c(NH3·H2O )+ c(OH-)
D.点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使Na2S溶液中c(Na+)/c(S2-)的比值变小,可采取的措施是( )
①适量盐酸 ②适量NaOH(s) ③适量KOH(s) ④适量KHS(s) ⑤加水 ⑥适量Cl2溶液⑦加热
A. ②③④ B. ①②⑤⑥⑦
C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化,还可以作为贵金属的萃取剂。可由硫和氯气在100~110℃直接化合而成。实验室用以下装置制备S2Cl2并对尾气进行回收利用。已知S2Cl2的熔点:-77℃,沸点:137℃。S2Cl2遇水剧烈反应。
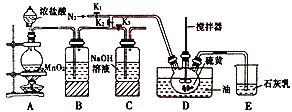
(1)反应前必须进行的操作是:__________。
(2)写出装置A中发生反应的离子方程式:__________。
(3)B中所装试剂名称为__________, 其作用是__________。
(4)通入N2的目的是__________。
A、B装置中的空气可以通过控制K2、K3来去除,具体方法为__________。
(5)S2Cl2遇水会生成淡黄色单质、一种能使品红溶液褪色的气体化合物和酸雾,写出该反应的化学方程式__________。
(6)实验时,D装置开始需要油浴加热一段时间,之后停止加热,仅需通入氯气即可。则生成二氯化二硫的反应为__________(填“放热”或“吸热”)反应。
(7)该装置由于存在缺陷,使制得的二氯化二硫可能不纯,简述改进方法__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水钴矿的主要成分为Co2O3,还含SiO2及少量Al2O3、Fe2O3、 CuO、MnO2等。一种利用水钴矿制取CoCl2·6H2O 的工艺流程如下:
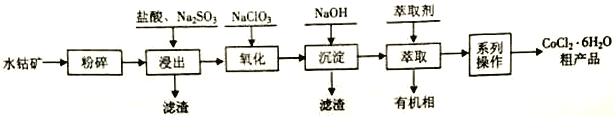
已知: ①CoCl2·6H2O受热易失去结晶水。
②25 ℃时,设定溶液中某金属离子初始浓度为0.1 molL-1,部分沉淀的参考数据如下表(“沉淀完全”指溶液中该离子浓度≤1.0×10-5molL-1):
沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀的pH | 3.4 | 1.5 | 6.3 | 7.0 | 4.7 | 8.1 |
沉淀完全时pH | 4.7 | 2.8 | 8.3 | 9.0 | 6.7 | 10.1 |
回答下列问题
(1)计算25℃时Co(OH)2的Ksp =_______________。
(2)浸出工序中加入一定量的Na2SO3还原Co2O3、MnO2等,Co2O3发生反应的离子方程式为_______________________________。
(3)氧化工序要控制NaClO3用量,若不慎加入过量NaClO3,可能生成的有毒气体是______________;氧化工序主要反应的离子方程式为_______________________________。
(4)已知温度对铜、钴、铁的浸出率的影响如左下图,萃取剂A、B中pH对钴、锰离子萃取率的影响如右下图:

①浸出温度控制在50-60℃的原因是_________________________。
②应选择萃取剂_________________________(填“A”或“B”)。
(5)“系列操作”依次是____________、______________和过滤等;制得的CoCl2·6H2O需减压烘干的原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银属于贵重金属,主要应用于化工、电子、感光材料等行业。某研究性学习小组设计一种提取光盘金属层中少量Ag 的方案如下图所示(忽略其他低含量金属对实验的影响) :
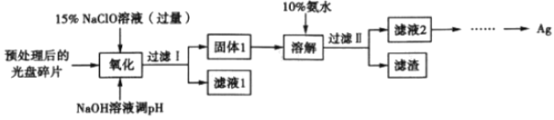
该小组查阅资料得知如下信息:
①NaClO 溶液在受热或酸性条件下易分解,如3NaClO==2NaCl+NaClO3 ;
②AgCl 可溶于氨水:AgCl+2NH3·H2O![]() Ag( NH3)2++Cl-+2H2O。
Ag( NH3)2++Cl-+2H2O。
回答下列问题:
(1)“氧化”步骤的产物为AgCl、NaOH 和O2,则该反应的化学方程式为__________。“氧化”阶段需在80℃条件下进行,温度过高或过低都不利于银的转化,其原因是_______________________________。
(2)该流程中,将银转化为固体1,然后又用氨水溶解转变为滤液2,其目的是_________________。
(3)若省略“过滤I”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO 与NH3·H2O反应外( 该条件下NaClO3与NH3·H2O不反应),还因为____________________。
(4)在实验室用葡萄糖(用GCHO表示)可以将滤液2还原为单质Ag,同时生成NH3,葡萄糖被氧化为葡萄糖酸铵(用GCOONH4 表示)。写出该反应的离子方程式:______________________________________。
(5)下图为该小组设计电解精炼银的示意图,则粗银为______(填“a”或“b”)极。若b 极有少量红棕色气体生成,则生成该气体的电极反应式为______________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com