
| A. | 若n(HA)=n(NaOH),则a+b≥14 | B. | 若n(HA)>n(NaOH),则a+b<14 | ||
| C. | 若混合后溶液pH=7,则n(HA)≥n(NaOH) | D. | 若混合后溶液pH>7,则n(HA)<n(NaOH) |
分析 A.如果n(HA)=n(NaOH),二者体积相等,则c(HA)=c(NaOH),HA溶液中c(HA)≥10-amol/L,NaOH溶液中c(NaOH)=$\frac{1{0}^{-14}}{1{0}^{-b}}$mol/L=10 b-14 mol/L;
B.若n(HA)>n(NaOH),二者体积相等,则c(HA)>c(NaOH),HA溶液中c(HA)≥10-amol/L,NaOH溶液中c(NaOH)=$\frac{1{0}^{-14}}{1{0}^{-b}}$mol/L=10 b-14 mol/L;
C.若混合后溶液pH=7,如果酸是强酸,则二者的物质的量相等,如果酸是弱酸,酸的物质的量应该大于碱;
D.若混合后溶液pH>7,如果酸是强酸,酸的物质的量应该小于碱,如果酸是弱酸,酸的物质的量可以等于碱的物质的量.
解答 解:A.如果n(HA)=n(NaOH),二者体积相等,则c(HA)=c(NaOH),HA溶液中c(HA)≥10-amol/L,NaOH溶液中c(NaOH)=$\frac{1{0}^{-14}}{1{0}^{-b}}$mol/L=10 b-14 mol/L,所以10-amol/L≤10 b-14 mol/L,则a+b≥14,故A正确;
B.若n(HA)>n(NaOH),二者体积相等,则c(HA)>c(NaOH),HA溶液中c(HA)≥10-amol/L,NaOH溶液中c(NaOH)=$\frac{1{0}^{-14}}{1{0}^{-b}}$mol/L=10 b-14 mol/L,10-amol/L≥10 b-14 mol/L,a+b≤14,故B错误
C.若混合后溶液pH=7,如果酸是强酸,则二者的物质的量相等,如果酸是弱酸,酸的物质的量应该大于碱,所以存在n(HA)≥n(NaOH),故C正确;
D.若混合后溶液pH>7,如果酸是强酸,酸的物质的量应该小于碱,如果酸是弱酸,酸的物质的量可以等于碱的物质的量,也可能是小于碱的物质的量或大于碱的物质的量,故D错误;
故选AC.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确混合溶液中的溶质及其性质是解本题关键,可以选项采用代入法分析判断,易错选项是D.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 催化剂的使用,可以降低反应的温度,起到节能的效果 | |
| B. | 陶瓷刀大多是用一种纳米材料“氧化锆”为原料加工而成,具有硬度高、导热性好、抗腐蚀等优点 | |
| C. | 石墨烯是一种由碳原子构成的单层片状结构的新材料,因此具有巨大的表面积,通过穿透式电子显微镜可用于直接观测单原子的吸附和释放过程 | |
| D. | 推进脱硫、脱硝、除尘等设施改造,能大量减排SO2、NO2、PM2.5,使天空重现“蔚蓝” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶液蒸干最多可以得到4 mol NaCl | |
| B. | 将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4 | |
| C. | 向溶液中滴加KI淀粉溶液,溶液变蓝,则氯气一定过量 | |
| D. | 若通入氯气的体积为11.2 L(标准状况),反应的离子方程式为:2I-+Cl2=I2+2C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | K+、Fe3+、NO3-、SO42- | 少量KSCN | Fe3++3SCN-=Fe(SCN)3 |
| B | Na+、AlO2-、Cl-、OH- | 过量NaHCO3 | OH-+HCO3-=CO32-+H2O |
| C | H+、Ba2+、Al3+、HCO3- | 少量NaOH | Al3++3OH-=Al(OH)3↓ |
| D | K+、Na+、S2O32-、Cl- | 过量硫酸 | 2S2O32-+2H+=SO42-+3S↓+H2O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②①③ | C. | ①③② | D. | ③①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I A族和ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 因H2SO3的酸性比H2CO3强,所以S的非金属性比C强 | |
| C. | H2O2、CH3CH3、Cl-、K+中的电子数和质子数均分别相等 | |
| D. | Na+、Al3+、O2-、F-的半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为吸热反应 | B. | CO2中含α键又含π键 | ||
| C. | Na2CO3为离子晶体,只含离子键 | D. | 每消耗2.24LCO2生成0.4克金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
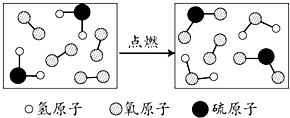
| A. | 反应物中有单质 | B. | 该反应为置换反应 | ||
| C. | 生成物的分子个数比为1:1 | D. | 化学反应前后原子的种类不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应中消耗0.1molCl2,转移的电子数一定为0.2NA | |
| B. | 15gCH3+(碳正离子)中含有的电子数为10NA | |
| C. | 标准状况下,0.5mol氦气含有的电子数为NA | |
| D. | 0.1L 2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com