
| A. | 保持温度不变,缩小容器的体积,平衡向逆反应方向移动,再次达到平衡时气体的颜色变浅了 | |
| B. | 若保持恒温恒压,再充入一定量的NO2气体,当容器的体积不再变化时表明重新达到平衡状态 | |
| C. | 保持容器的体积不变,升高温度,正反应速率加快,逆反应速率减慢,平衡向正反应方向移动 | |
| D. | 恒温恒容条件下,再充入一定量的N2O4,达到新平衡时NO2的体积分数比原平衡的大 |
分析 A、缩小体积,各种物质的浓度均增大,所以颜色加深;
B、加入少许NO2平衡向逆反应方向移动,N2O4浓度增大,正反应速率增大,逆反应速率瞬间增大,然后降低;
C、升高温度,正逆反应速率均加快;
D、体积不变,加入少许N2O4,平衡向正反应移动,NO2浓度增大,NO2是红棕色气体.
解答 解:A、缩小体积,各种物质的浓度均增大,所以颜色加深,故A错误;
B、少许NO2平衡向逆反应方向移动,N2O4浓度增大,正反应速率增大,逆反应速率瞬间增大,然后降低,当容器的体积不再变化时表明重新达到平衡状态,故B正确;
C、升高温度,正逆反应速率均加快,故C错误;
D、恒温恒容,再充入一定量的四氧化二氮,相当于加压效果,所以达到新平衡时二氧化氮的体积分数比原平衡的小,故D错误,
故选B.
点评 本题主要考查的是化学反应平衡的影响因素,涉及压强、浓度、温度等的影响,难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
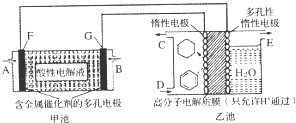
| A. | 甲池中A处通入H2,E处有O2放出 | B. | 甲池中H+由F极移向G极 | ||
| C. | 乙池中阴极区只有苯被还原 | D. | 导线中共传导11.2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X离子的氧化性大于Y离子 | B. | W的气态氢化物的稳定性比Z的弱 | ||
| C. | 含Y的盐溶液一定显酸性 | D. | X离子的半径小于W离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
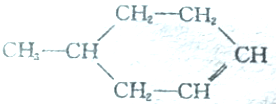 可以写成
可以写成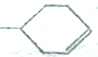 ,现有有机物A,可写为
,现有有机物A,可写为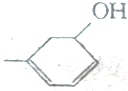
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 资料1 | 硫酸浓度mol/L | 黑色物质出现的温度∕℃ | 黑色物质消失的温度∕℃ |
| 15 | 约150 | 约236 | |
| 16 | 约140 | 约250 | |
| 18 | 约120 | 不消失 | |
| 资料2 | X射线衍射晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. | ||

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气和氯气反应生成氯化氢气体的热化学方程式是 H2 (g)+Cl2 (g)═2HCl(g) | |
| B. | 氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H═+183 kJ•mol-1 | |
| C. | 氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H═-183 kJ•mol-1 | |
| D. | 氢气和氯气反应生成 1 mol 氯化氢气体,反应的△H═-183 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com