
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| D. | M点的正反应速率小于W点的逆反应速率 |
分析 由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应;
A、根据图象判断参加反应的X的量的多少,反应的X越多,放热越多;
B、根据图中X的浓度变化求出Y的浓度变化,再求反应速率;
C、温度越高反应速率越大;
D.根据图象可知,温度为T1时反应首先达到平衡状态;温度高反应速率快,到达平衡的时间少,则温度是T1>T2,温度越高速率越大.
解答 解:由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应;
A、进行到M点X的转化率较低,由于正向是放热反应,所以反应进行到M点放出的热量少,故A错误;
B、T2下,在0~t1时间内,X的浓度变化为:c(X)=(a-b)mol/L,则Y的浓度变化为c(Y)=$\frac{1}{2}$c(X)=$\frac{(a-b)}{2}$mol/L,所以v(Y)=$\frac{a-b}{2{t}_{1}}$mol•L-1•min-1,故B错误;
C、根据图象可知,温度为T1时反应首先达到平衡状态;温度高反应速率快,到达平衡的时间少,则温度是T1>T2;M点温度高于N点温度,且N点反应没有达到平衡状态,此时反应向正反应方向进行,即N点的逆反应速率小于N点的正反应速率,因此M点的正反应速率大于N点的逆反应速率,故C正确;
D.根据图象可知,温度为T1时反应首先达到平衡状态;温度高反应速率快,到达平衡的时间少,则温度是T1>T2,M点的正反应速率大于W点的逆反应速率,故D错误;
故选C.
点评 本题考查了化学平衡图象问题、平衡有关计算、外界条件对平衡移动影响等,题目难度中等,根据图象判断反应为放热反应是解题的关键.注意把握图象中曲线的变化特点,分析外界条件对化学平衡的影响.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1molH2O所占体积约为22.4L | |
| B. | OH-所含电子数是10 | |
| C. | 0.5molH2和0.5molN2体积相同 | |
| D. | 从1L 0.5mol•L-1NaCl溶液中取出200mL溶液,其物质的量浓度为0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2FeO4和明矾都可做水处理剂,但工作原理不完全相同 | |
| B. | 氢能是一种新型能源,具有热值高、资源丰富、无毒、无污染的优点 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 合成氨工业中,使用催化剂不能提高H2和N2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
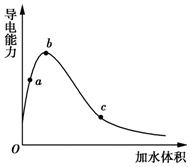 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )| A. | a、b、c三点溶液的pH:c<a<b | |
| B. | 用湿润的pH试纸测量a处溶液的pH,测量结果偏小 | |
| C. | a、b、c三点CH3COOH的电离程度:c<a<b | |
| D. | a、b、c三点溶液用1 mol•L-1 NaOH溶液中和,消耗NaOH溶液体积:c<a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
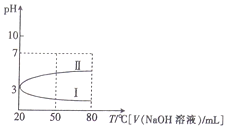
| A. | 0.1mol•L-1NH4Al(SO4)2溶液c(NH4+)大于等浓度的NH4HSO4溶液中c(NH4+) | |
| B. | 向100mL0.1mol•L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol•L-1NaOH 溶液时,溶液pH的变化如曲线II | |
| C. | 升高温度,NH4Al(SO4)2溶液的pH减小,是因为促进了NH4Al(SO4)2的电离 | |
| D. | 20℃时,0.1mol•L-1NH4Al(SO4)2溶液中:2c(SO42-)-c(NH4+)-3c(Al3+)=10-3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
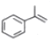 (异丙烯苯)$→_{一定条件}^{+H_{2}}$
(异丙烯苯)$→_{一定条件}^{+H_{2}}$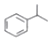 (异丙苯),下列说法错误的是( )
(异丙苯),下列说法错误的是( )| A. | 反应属于加成反应 | B. | 异丙苯的一氯代物共有6种 | ||
| C. | 可用溴水鉴别异丙烯苯和异丙苯 | D. | 异丙苯是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com