
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧离子(O2-)的结构示意图: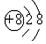 | |
| C. | 氧原子最外层p亚层电子排布式:2s22p4 | |
| D. | 某碳氧化合物电子式: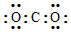 |
分析 A.核素符号ZAX,左下角Z代表质子数,左上角A代表质量数,X代表元素符号,Z可以省略,其中质量数=质子数+中子数;
B.阳离子核内8个质子,核外10个电子,分布在两个电子层,从内到外依次2,8;
C.氧原子最外层6个电子,其中2p轨道中有4个电子;
D.二氧化碳中碳与氧原子分别共用2对电子.
解答 解:A.质子数为8,中子数为10的氧原子的质量数为8+10=18,核素符号为818O或18O,故A正确;
B.阳离子核内8个质子,核外10个电子,分布在两个电子层,从内到外依次2,8,结构示意图为: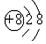 ,故B正确;
,故B正确;
C.氧原子最外层p亚层电子排布式:2p4,故C错误;
D.CO2是共价化合物,碳原子和氧原子之间有2对共用电子对,其电子式为 ,故D错误;
,故D错误;
故选:AB.
点评 本题考查了电子式、结构式的书写,核外电子排布,题目难度中等,试题题量较大,充分考查了学生对书写知识的掌握情况,试题有利于培养学生灵活应用所学知识的能力.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 向铝盐溶液中不断加入小苏打 | B. | 向偏铝酸钠溶液中不断滴加盐酸 | ||
| C. | 向烧碱溶液中不断滴入铝盐溶液 | D. | 向铝盐溶液中不断滴入烧碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-、K+、Cl- | B. | Ba2+、Na+、Br- | C. | Na+、Fe3+、SO42- | D. | K+、NO3-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去Cl2中的HCl:将混合气体通过AgNO3溶液 | |
| B. | 除去C2H6中的C2H4:将混合气体通过酸性KMnO4溶液 | |
| C. | 检验CO2中是否混有HCl:将气体通入饱和NaHCO3溶液 | |
| D. | 检验Cl2中是否混有空气:将装有气体的试管倒置在NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉溶液中滴入碘水--变蓝色 | B. | KSCN溶液中滴入Fe3+--变血红色 | ||
| C. | 氯化银见光分解--变银白色 | D. | 无水硫酸铜在空气中久置--变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 性质 结构 信息 | 单质银白色,燃烧时火焰呈黄色. | 其单质是空气的主要成分,化学性质非常稳定. | 原子的3p亚层上有5个电子. | +2价阳离子的核外电子排布与氖原子相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
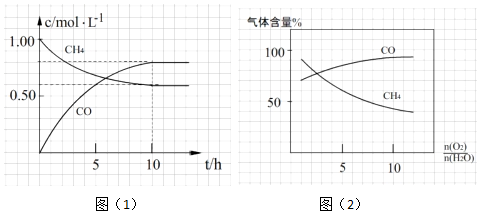
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com