
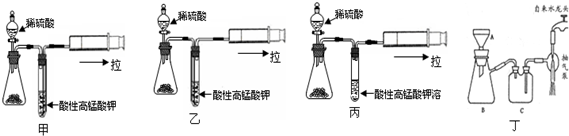
 (1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题:
(1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题:分析 (1)①生石灰加入小试管内,然后注入足量水,发生反应生成氢氧化钙;
②生石灰与水的反应为放热反应,反应放出的热量使气体膨胀;
(2)根据平衡常数的表达式等于生成物浓度的幂次方之积比上反应物浓度的幂次方之积书写.
解答 解:(1)生石灰加入小试管内,然后注入足量水,发生反应生成氢氧化钙,方程式为CaO+H2O=Ca(OH)2,故答案为:CaO+H2O=Ca(OH)2;
②生石灰与水的反应为放热反应,反应放出的热量使气体膨胀,使U形管液面A下降,故答案为:下降;放热;
(2)①2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0,K=$\frac{c(CO{\;}_{2}){\;}^{2}}{C(NO){\;}^{2}C(CO){\;}^{2}}$,故答案为:K=$\frac{c(CO{\;}_{2}){\;}^{2}}{C(NO){\;}^{2}C(CO){\;}^{2}}$;
②C(s)+CO2(g)?2CO(g)△H>0,K=$\frac{c(CO){\;}^{2}}{c(CO{\;}_{2})}$,故答案为:K=$\frac{c(CO){\;}^{2}}{c(CO{\;}_{2})}$;
点评 本题考查吸热反应和放热反应以及平衡常数表达式的书写,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| B. | NH4HCO3溶液与足量NaOH溶液混合加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O | |
| C. | 氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )
温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )| A. | 该反应的平衡常数表达式K=$\frac{c(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | |
| C. | 反应至15 min时,改变的条件是升高温度 | |
| D. | 反应在前10 min的平均反应速率:v(D)=0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
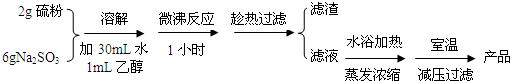
| 组号 | 反应温度(℃) | Na2S2O3 | H2O | H2SO4 | ||
| V/mL | c/mol•L-1 | V/mL | V/mL | c/mol•L-1 | ||
| ① | 10 | 10 | 0.1 | 0 | 10 | 0.1 |
| ② | 10 | 5 | 0.1 | 5 | 10 | 0.1 |
| ③ | 30 | 10 | 0.1 | 0 | 10 | 0.1 |
| ④ | 30 | 5 | 0.1 | 5 | 10 | 0.1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,H2S浓度增加,表明正反应是吸热反应 | |
| B. | 反应前H2S物质的量为7mol | |
| C. | 通入CO后,正反应速率逐渐增大,逆反应速率减小 | |
| D. | CO的平衡转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),EVA
),EVA| A. | EVA材质属于高分子化合物材质 | |
| B. | NH3溶于水能导电,所以NH3是电解质 | |
| C. | 甲酰胺的摩尔质量为45 | |
| D. | 甲酰胺分解生成CO和NH3属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图锥形瓶中装满了c mol•Lˉ1的Na2SO4溶液,经测定其中含有a mol Na+,则锥形瓶容
如图锥形瓶中装满了c mol•Lˉ1的Na2SO4溶液,经测定其中含有a mol Na+,则锥形瓶容| A. | $\frac{a}{c}$ L | B. | $\frac{a}{2c}$L | C. | ac L | D. | 2ac L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com