
| A. | $\frac{ρ}{800}$mol•L-1 | B. | 1.25ρmol•L-1 | C. | $\frac{ρ}{1600}$mol•L-1 | D. | 0.63mol•L-1 |
分析 根据n=$\frac{m}{M}$计算钙离子物质的量,根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算c(Ca2+),而溶液中c(Cl-)=2c(Ca2+),溶液是均一的取出溶液中Cl-的浓度与原溶液中的相等.
解答 解:2gCa2+离子物质的量为$\frac{2g}{40g/mol}$=0.05mol,溶液体积=$\frac{80g}{1000ρg/L}$=$\frac{8}{100ρ}$l,则原溶液中c(Ca2+)=$\frac{0.05mol}{\frac{8}{100ρ}L}$=$\frac{5ρ}{8}$mol/L,而原溶液中c(Cl-)=2c(Ca2+)=1.25ρ mol/L,溶液是均一的取出溶液中Cl-的浓度与原溶液中的相等,故取出一半的溶液中Cl-的浓度是1.25ρ mol/L,
故选:B.
点评 本题考查物质的量浓度有关计算,注意对公式的理解,有利于基础知识的巩固.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
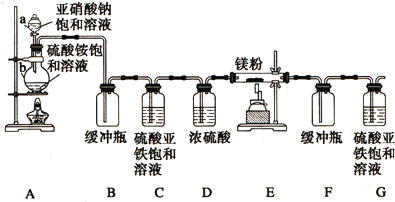
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其密度之比等于物质的量之比 | |
| B. | 其密度之比等于摩尔质量之比 | |
| C. | 等质量的三种气体,其体积比等于相对分子质量之比 | |
| D. | 等体积的三种气体,其物质的量之比等于相对分子质量之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe0溶于稀硝酸:FeO+2H+═Fe2++H2O | |
| B. | 明矾溶液中滴加过量氨水:Al3++3NH3.H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| C. | 漂白粉溶液中通入S02:Ca2++2ClO-+SO2+H2O═2HClO+CaSO3↓ | |
| D. | 小苏打溶液中加足量澄清石灰水:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+2H2O+CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂会使K变化但△H不变 | |
| B. | 使用催化剂会使△H增大,但K不变 | |
| C. | 使用催化剂和提高温度均可增大H2的转化率 | |
| D. | 在一密闭容器中,投入浓度均为1mol•L-1的 N2、H2、NH3,平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 性质 | 8O | 16S | Se | 52Te |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1 390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径(nm) | 0.074 | 0.102 | 0.116 | 0.143 |
| 单质与H2反应 | 点燃易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com