


 ,反应④的反应类型是消去反应.
,反应④的反应类型是消去反应. 分析 (1)由碳碳双键为平面结构分析环戊二烯分子中最多共平面的原子数;
(2)金刚烷的分子中有6个CH2,4个CH结构,据此判断其分子式;
(3)由合成路线可知,反应①为光照条件下的取代反应,反应②为消去反应,反应③为加成反应,反应④为消去反应,以此来解答.
解答 解:(1)C=C为平面结构,与双键碳直接相连的原子一定在同一平面内,则5个C和4个H在同一平面内,
故答案为:9;
(2)由C原子形成4个共价键,由结构简式可知金刚烷的分子中有6个CH2,4个CH结构,分子式为C10H16,
故答案为:C10H16;6;
(3)由合成路线可知,反应①为光照条件下的取代反应,其产物名称为氯代环戊烷;反应②卤素原子的消去反应,反应条件为氢氧化钠的醇溶液;反应③为加成反应,反应方程式为: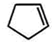 +Br2→
+Br2→ ,反应④为卤代烃的消去反应,
,反应④为卤代烃的消去反应,
故答案为: +Br2→
+Br2→ ;消去反应.
;消去反应.
点评 本题考查有机物的合成,题目难度中等,注意把握有机物的官能团、碳链骨架等的变化,明确发生的反应及习题中的信息即可解答,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | |||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ④ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 增大压强 | C. | 使用催化剂 | D. | 增大AB2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验编号 | T(℃) | NO初始浓(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) | B. | (NH4)2CO3(s)═NH4HCO3(g)+NH3(g) | ||
| C. | 2CO(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2CO2(g) | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(N2)=0.25mol/(L•min) | B. | υ(H2)=0.75mol/(L•min) | ||
| C. | υ(NH3)=1mol/(L•min) | D. | υ(NH3)=0.5mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 | |
| B. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 | |
| C. | 炼铁是铁矿石在高温下被氧化的过程 | |
| D. | 钴的制备:3Co3O4+8Al$\stackrel{高温}{→}$9Co+4Al2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com