
| A. | 盐酸>醋酸 | B. | 醋酸>盐酸 | C. | 盐酸=醋 | D. | 无法判断 |
分析 醋酸为弱电解质,溶液中存在电离平衡,加水稀释后醋酸的电离程度增大,溶液中氢离子浓度物质的量增大;氯化氢为强电解质,溶液中完全电离,加水稀释后氢离子的物质的量基本不变,据此分析.
解答 解:醋酸是弱酸,加水后醋酸电离程度增大,溶液中氢离子的物质的量增大;而盐酸是强酸,在水中完全电离,加水后,氢离子浓度只是减小,所以pH相等的盐酸和醋酸溶液都稀释相同的倍数后,醋酸中氢离子浓度大于盐酸,溶液中氢离子浓度越大,溶液pH越小,则溶液的pH大小为:盐酸>醋酸,
故选A.
点评 本题考查了溶液pH的计算、弱电解质的电离平衡及其影响,题目难度不大,注意掌握溶液的pH的概念及计算方法,明确弱电解质的电离及其影响因素


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是从源头上防止和消除化工生产对环境的污染 | |
| B. | 减少化石燃料的使用,有利于降低空气中pM2.5的数值 | |
| C. | “地沟油”禁止食用,但可以用来制柴油、肥皂等 | |
| D. | 淀粉、豆油、蛋白质都是天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
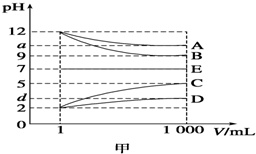 物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4 | B. | 1:2 | C. | 1:4 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K1=1.76×10-5 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 中和等体积、等pH的CH3COOH溶液和HCN溶液消耗NaOH的量前者大于后者 | |
| B. | 可发生反应:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ | |
| C. | Na+、CN-、CH3COO-、HCO3-等离子能大量共存 | |
| D. | 等浓度的CH3COONa和NaCN溶液pH前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
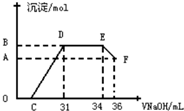 研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )
研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )| A. | 图中OC段的离子方程式为:NH4++OH-═NH3•H2O | |
| B. | 在DE段的离子方程式为:H++OH-═H2O | |
| C. | B与A的差值为 0.002mol | |
| D. | C点对应的氢氧化钠溶液的体积为7 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com