
| A. | 苯酚和甲醛在一定条件下可合成酚醛树脂 | |
| B. |  的单体是 HOCH2CH2OH 与 的单体是 HOCH2CH2OH 与  | |
| C. | 聚苯乙烯是由苯乙烯加聚生成的纯净物 | |
| D. | 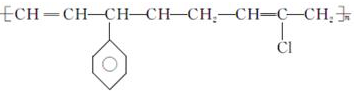 的单体有3种 的单体有3种 |
分析 A.苯酚和甲醛发生缩聚反应;
B. 中含-COOC-及端基原子和原子团,为缩聚产物;
中含-COOC-及端基原子和原子团,为缩聚产物;
C.聚苯乙烯中聚合度n不确定;
D.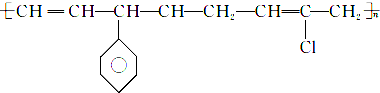 中主链只含C,为加聚反应产物.
中主链只含C,为加聚反应产物.
解答 解:A.苯酚和甲醛发生缩聚反应生成酚醛树脂,故A正确;
B. 中含-COOC-及端基原子和原子团,为缩聚产物,其单体为HOCH2CH2OH与
中含-COOC-及端基原子和原子团,为缩聚产物,其单体为HOCH2CH2OH与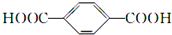 ,故B正确;
,故B正确;
C.聚苯乙烯中聚合度n不确定,则属于混合物,可由苯乙烯加聚生成,故C错误;
D.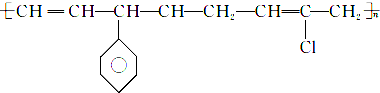 中主链只含C,为加聚反应产物,则单体为乙炔、苯乙烯、2-氯-1,3-丁二烯,故D正确;
中主链只含C,为加聚反应产物,则单体为乙炔、苯乙烯、2-氯-1,3-丁二烯,故D正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握高分子化合物的合成反应为解答的关键,侧重加聚和缩聚反应及单体推断的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
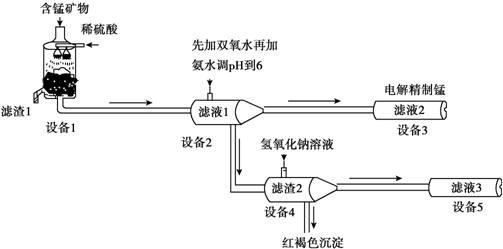
 (5)设备3中用阴离子膜法提取金属锰的电解装置如图:
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:C(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+ )>c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖浓度太大 | B. | 加热时间不够 | ||
| C. | CuSO4溶液的量不够 | D. | NaOH溶液的量不够 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强 | |
| B. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| C. | 一种元素可能有多种氧化物,但同一化合价只对应一种氧化物 | |
| D. | 强氧化剂与强还原剂不一定能发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.72、1.56、6.72 | B. | 4.62、5.6、3.78 | C. | 6、8、7 | D. | 6.72、6.72、1.56 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 在AlCl3溶液中:K+、Na+、SiO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
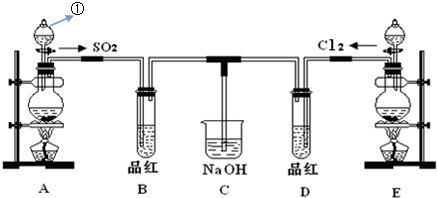
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为: ;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为
;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为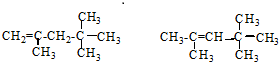 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com