
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知
X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼
铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满
状态,且核外的未成对电子只有一个。回答下列问题:
(1)从电负性角度分析,X,Y,Z三种元素的非金属活泼性由强到弱的顺序为 。
(2)X、Y分别与H形成的化学键的极性关系为X-H Y-H(填“<”、“>”或“=”)。
(3)+l价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二
电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第____电离能。
(4)X的氢化物中X原子的杂化方式为sp2,则相对分子质量最小的分子式为____,
(5)W的价电子排布图为 ;下图____表示的是W晶体中微粒的堆积方式(填甲、乙或丙);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为____(写出含a的表达式,用NA表示阿伏伽德罗常数)。
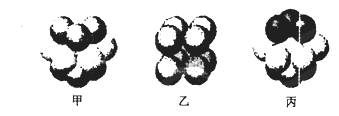
【知识点】物质结构与元素周期律 E4 E2 E3 N1 N3 N4
【答案解析】(1)O>C >Si (2分)
(2)< (2分)
(3)第五 (2分)
(4)C2H4,(2分)
 (5) (2分) 丙(2分)
(5) (2分) 丙(2分) 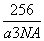 g/cm3(3分)
g/cm3(3分)
解析:(1)根据X的最外层电子数是其内层电子数的2倍知X是C,X、Y同周期,X与Y形成的常见化合物之一常被用于高炉炼铁推出Y是O,Z与X同主族,则Z是Si,W是Cu元素,X,Y,Z三种元素的非金属性由强到弱的顺序为O>C >Si。(2)由于O元素的电负性大于C元素,因此键的极性C-H < O-H(3)Si的最外层电子数为4,因此第五个电子失去会出现电离能突增。(4)C原子以sp2方式杂化,则应该形成碳碳双键,所以最小分子式为C2H4, (5)Cu的价电子排布3d104s1,其晶体中微粒的堆积方式为面心立方最密堆积,选择丙。用均摊法推知面心立方最密堆积Cu晶体中一个晶胞含有4个Cu原子,则一个晶胞的质量是4×64/NA,一个晶胞的体积是a3cm3,因此其密度为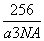 g/cm3。
g/cm3。
【思路点拨】根据元素的性质、原子结构特点找出元素推断的突破口;根据元素周期律进行解答;有关晶胞的计算往往涉及均摊法:(1)处于顶点的粒子,同时为8个晶胞所共有,每个粒子有1/8属于该晶胞(2)处于棱上的粒子,同时为4个晶胞共有,每个粒子有1/4属于该晶胞(3)处于面上的粒子,同时为2个晶胞共有,每个粒子有1/2属于该晶胞(4)处于晶胞内部的粒子,则完全属于该晶胞。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,J是一种黑色固体,I的浓溶液具有还原性,A~I均为中学化学常见物质,它们之间的转化关系如下图所示。(部分生成物和反应条件已略去)
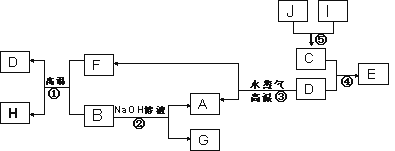
请回答下列问题:
(1) 写出组成物质D的元素在周期表中的位置:___________________。
(2) ①写出反应①的化学方程式:______________________________。
②由E的饱和溶液可以制得胶体,用化学方程式表示该过程的原理是_______________。
③写出反应②的离子方程式_________________________________。
(3) 已知G的水溶液显碱性,其原因是(用离子方程式表示)_________。
(4) J在H2O2分解反应中作催化剂。若将适量J加入酸化的H2O2溶液中,J溶解生成它的+2价离子,该反应的离子方程式是___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( ) 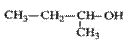
A. 的命名为:2-甲基-1-丙醇
B.软脂酸和油酸互为同系物
C.聚乙烯能使溴水褪色
D. 分子中至少有11个碳原子处于同一平面
分子中至少有11个碳原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
葡萄糖是人类的营养物质,在人体里,富氧条件下氧化生成CO2和水;在缺氧条件下生成一种有机酸A。
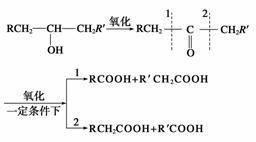
已知A可进行如下图所示的反应,其中C和C′是同系物,C′是甲酸(HCOOH),F为高分子化合物。

回答下列问题:
(1)D和D′属于________(用编号填入,下同)。
①同系物 ②同分异构体 ③同类物质 ④同素异形体
(2)D′和E分别属于哪一类化合物?
D′________,E________。
①多元醇 ②醛 ③不饱和羧酸 ④多元羧酸 ⑤酯
(3)写出结构简式:A________,F________,H________。
(4)写出反应类型:
(Ⅰ)________________________________________________________________________。
(Ⅱ)________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题。
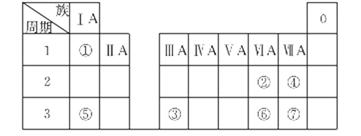
(1)④、⑤、⑦的原子半径由大到小的顺序为______________(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为________>__________
(3)④、⑥、⑦的气态氢化物的稳定性由弱到强的顺序是_______________。
(4)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项中,理由、结论及因果关系均正确的是 ( )
A.由于键能EN≡N> ECl-Cl,故单质的沸点:N2>Cl2
B.由于分子中可电离的H+个数H2SO4> CH3COOH,故两者的酸性:H2SO4>CH3COOH
C.由于元素的非金属性N>P,故氢化物的稳定性:NH3>PH3
D.由于金属性Fe>Cu, 故还原性Fe2+>Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列几种物质的熔点和沸点数据,判断下列有关说法中,错误的是( )。
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B | |
| 熔点/℃ | 810 | 710 | 190 | -68 | 2 300 |
| 沸点/℃ | 1 465 | 1 418 | 182.7 | 57 | 2 500 |
注:AlCl3熔点在2.02×105 Pa条件下测定。
A.SiCl4是分子晶体
B.单质B是原子晶体
C.AlCl3加热能升华
D.MgCl2所含离子键的强度比NaCl大
查看答案和解析>>
科目:高中化学 来源: 题型:
向1.0 L 0.30 mol·L-1的NaOH溶液中缓慢通入8.8 g CO2气体,使其完全反应,对反应后的溶液,下列判断正确的是( )
A.溶质为Na2CO3
B.溶质为NaHCO3
C. c(Na+)=c(HCO
c(Na+)=c(HCO )+c(CO
)+c(CO )+c(H2CO3)
)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO )+2c(CO
)+2c(CO )+c(OH-)
)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com