有铁和锌的混合物共9.3g,与200mL盐酸恰好完全反应,在标准状况下共收集到3.36L H2,求:
(1)H2的物质的量是多少?
(2)铁的质量是多少克?
(3)反应完毕后,溶液中Zn2+的物质的量浓度为多少?
【答案】
分析:(1)根据n=
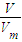
计算标准状况下3.36L H
2的物质的量;
(2)令铁和锌的物质的量分别为amol、bmol,利用二者质量之和与生成氢气的物质的量之和,列方程计算a、b的值,再根据m=nM计算铁的质量;
(3)根据锌元素守恒有n(Zn
2+)=n(Zn),根据c=
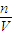
计算溶液中Zn
2+的物质的量浓度.
解答:解:(1)标准状况下3.36L H
2的物质的量为
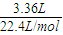
=0.15mol,
答:H
2的物质的量是0.15mol;
(2)令铁和锌的物质的量分别为amol、bmol,则:
Fe~~~~H
2 amol amol
Zn~~~~H
2 bmol bmol
所以
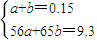
解得:a=0.05,b=0.1
故混合物铁的质量为0.05mol×56g/mol=2.8g,
答:混合物中铁的质量为2.8g;
(3)根据锌元素守恒有n(Zn
2+)=n(Zn)=0.1mol,溶液的体积为200mL,
故溶液中Zn
2+的物质的量浓度为
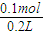
=0.5mol/L,
答:反应完毕后,溶液中Zn
2+的物质的量浓度为0.5mol/L.
点评:本题考查常用化学计量的有关计算、根据方程式进行的计算,比较基础,注意对基础知识的理解掌握.

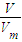 计算标准状况下3.36L H2的物质的量;
计算标准状况下3.36L H2的物质的量;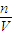 计算溶液中Zn2+的物质的量浓度.
计算溶液中Zn2+的物质的量浓度.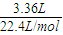 =0.15mol,
=0.15mol,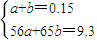
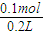 =0.5mol/L,
=0.5mol/L,
