
| A. | 标准状况下5.6L CH4含有的共用电子对数目为NA | |
| B. | 25℃时,pH=1的硫酸溶液中含有H+的数目为0.1NA | |
| C. | 常温下,23g NO2和N2O4混合气体中所含原子总数为1.5NA | |
| D. | 将0.5mol NH4NO3于稀氨水使溶液呈中性,溶液中NH4+数目为0.5NA |
分析 A.标准状况下5.6L CH4含物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,甲烷分子中含四个共用电子对;
B.溶液体积不知不能计算微粒数;
C.NO2和N2O4的最简式均为NO2;
D.依据溶液中电荷守恒分析;
解答 解:A.标准状况下5.6L CH4含物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,甲烷分子中含四个共用电子对,含有的共用电子对数目为NA ,故A正确;
B.溶液体积不知,25℃时,pH=1的硫酸溶液中含有H+的数目不能计算,故B错误;
C.NO2和N2O4的最简式均为NO2,故23g混合物中含有的NO2的物质的量=$\frac{23g}{46g/mol}$=0.5mol,则含原子0.5×3×NA=1.5NA,故C正确;
D.将0.5mol NH4NO3于稀氨水使溶液呈中性,c(H+)+c(NH4+)=c(OH-)+c(NO3-),c(H+)=c(OH-),c(NH4+)=c(NO3-),物质的量n(NH4+)=n(NO3-)=0.5mol,溶液中NH4+数目为0.5NA,故D正确;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,根据离子晶体中离子组成氧化还原等知识来解答,为易错题,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 在原电池的外电路中,电子由正极通过导线流向负极 | |
| B. | 在原电池的电解质溶液中,阳离子向负极移动 | |
| C. | 锌锰子电池是一种常用的一次性电池 | |
| D. | 氢氧燃料电池中氢气在负极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻二甲苯和对二甲苯 | B. | C4H8O2和C3H6O2 | ||
| C. | C4H10和C20H42 | D. | C6H5-OH和C6H5-CH2-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 东晋葛洪《肘后备急方》中记载了“青蒿一握,以水二升渍,绞取汁,…”,此过程属于物理变化 | |
| B. | 日本福岛核电站事故中,核原料裂变产生的2种放射性同位素碘-131和铯-137的中子数不同 | |
| C. | 乙烯与氧气在银催化作用下生成环氧乙烷符合绿色化学的原子经济性要求 | |
| D. | PM2.5是指天气中直径接近2.5×10-6m的颗粒物,其分散在空气中形成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
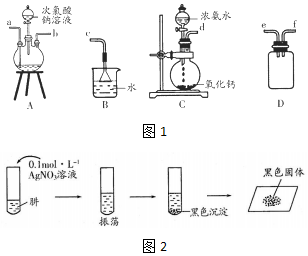
| 实验编号 | 操作 | 现象 | 实验结论 |
| 1 | 取少量黑色固体于试管,加入足量氨水,振荡 | 黑色固体不溶解 | 假设1成立 |
| 2 | 操作同实验1 | 黑色固体完全溶解 | 假设2成立 |
| 3 | ①取少量黑色固体于试管中,加入适量氨水,振荡,静置,取上层清液于洁净试管中,加入几滴乙醛,水浴加热②取少量黑色固体于试管中,加入足量稀硝酸,振荡 | ①试管内壁有银镜生成 ②固态完全溶解,并有气体产生 | 假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
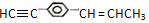 的说法正确的是( )
的说法正确的是( )| A. | 所有碳原子有可能都在同一平面上 | |
| B. | 最多只可能有9个碳原子在同一平面上 | |
| C. | 有7个碳原子可能在同一直线上 | |
| D. | 至少有6个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 现象 | 结论 |
| A | 向SiO2固体中加入足量盐酸 | 固体不溶解 | SiO2不溶于任何酸 |
| B | 向Na2CO3溶液中通入足量CO2 | 产生晶体 | 溶解度:NaHCO3>Na2CO3 |
| C | 向75%的酒精中加入小粒钠 | 产生气泡 | 乙醇与钠反应产生H2 |
| D | 向KI 淀粉溶液中通入气体X | 溶液变蓝 | X的氧化性比I2的氧化性强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com