
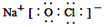 ;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O
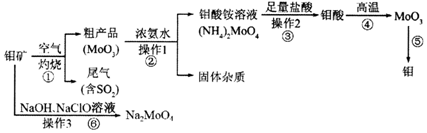
;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O分析 制备金属钼和钼酸钠:钼矿的主要成分为MoS2,在空气中燃烧2MoS2+7O2$\frac{\underline{\;点燃\;}}{\;}$2MoO3+4SO2,生成MoO3和SO2,二氧化硫属于酸性氧化物,能被碱液吸收,所以尾气含SO2用浓氨水吸收,二氧化硫具有还原性,则同时通入氧气生成硫酸铵;MoO3加浓氨水生成钼酸铵溶液,2NH3•H2O+MoO3═(NH4)2MoO4+H2O,过滤除去杂质,在钼酸铵溶液中加足量盐酸,发生复分解反应生成钼酸和氯化铵,钼酸为难溶于水和酸的黄色晶体,过滤得到钼酸晶体高温分解生成MoO3,在高温条件下用氢气还原得到金属钼;
钼矿与NaOH、NaClO溶液发生反应MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O,通过蒸发浓缩冷却结晶洗涤干燥得到钼酸钠,据此分析解答.
解答 解:(1)应①中反应为2MoS2+7O2$\frac{\underline{\;点燃\;}}{\;}$2MoO3+4SO2,Mo元素化合价由+4升高到+6,S元素由-2升高到+4,化合价升高被氧化,由方程可知,生成4molSO2时转移28mol电子,当生成l mol SO2时,该反应转移电子的物质的量为7mol;反应②为MoO3加浓氨水生成钼酸铵溶液,化学方程式为:2NH3•H2O+MoO3═(NH4)2MoO4+H2O;
故答案为:钼、硫;7;2NH3•H2O+MoO3═(NH4)2MoO4+H2O;
(2)NaClO的电子式为: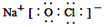 ;反应⑥生成三种钠盐,写出该反应的离子方程式为:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O;
;反应⑥生成三种钠盐,写出该反应的离子方程式为:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O;
故答案为: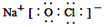 ;MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O;
;MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O;
(3)滤液中有少量浑浊,从实验操作的角度分析,可能的原因是过滤时漏斗中的液面高出滤纸边缘或玻璃棒靠在单层滤纸一边弄破滤纸;
故答案为:过滤时漏斗中的液面高出滤纸边缘(或玻璃棒靠在单层滤纸一边弄破滤纸);
(4)该电池以金属锂为负极时,充电时反应为:LIxMoO3•H2O=MoO3•H2O+xLi,阴极反应为:xLi++xe-=xLi,则阳极反应式为:LIxMoO3•H2O-xe-=xLi++MoO3•H2O;
故答案为:LIxMoO3•H2O-xe-=xLi++MoO3•H2O;
(5)根据CO2+CH4$\frac{\underline{\;高温\;}}{\;}$2CO+2H2、CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2知,生成(CO+H2)体积是消耗甲烷体积的4倍,CO和氢气还原MoO3制钼时,每个分子CO和H2失去电子数相同,
含甲烷体积分数为80%的lm3(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,则甲烷转化的物质的量=$\frac{1×1{0}^{3}×80%×90%L}{22.4L/mol}$=32.1mol,
则生成CO和氢气物质的量之和为128.4mol,
根据转移电子守恒得生成Mo的质量=$\frac{128.4mol×2}{6}$×96g/mol×10-3kg=4.1kg;
故答案为:4.1.
点评 本题考查物质的制备实验及混合物的分离和提纯,为高频考点,把握流程图中每一步发生的反应及操作方法是解本类型题的关键,注意结合题给信息解答,侧重分析与计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.15 mol•L-1 | B. | 0.10 mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.40 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:3:1 | B. | 2:2:3 | C. | 1:3:4 | D. | 3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A. | 达平衡后升温,反应速率增大,压强减小 | |
| B. | 其他条件不变,增加压强能提高CO的转化率 | |
| C. | 该反应△H>0 | |
| D. | 830℃时,在2 L的密闭容器中加入4 mol CO(g)和4 mol H2O(g),平衡时,CO的转化率是50% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是酸性氧化物,不与任何酸反应 | |
| B. | 将氯气通入紫色石蕊试液,先变红,后褪色 | |
| C. | 次氯酸不稳定,见光易分解 | |
| D. | SO2使紫色酸性高锰酸钾溶液褪色,体现了SO2强还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 能与铝反应放出氢气的溶液中:K+、Ca2+、Cl-、HCO3- | |
| C. | pH=2的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯气通入H2S溶液中,有沉淀产生 | |
| B. | 对比氯气和硫磺在水中的溶解性 | |
| C. | 一定条件下铁分别与硫、氯反应,比较生成物中铁价态 | |
| D. | 比较这两种元素的原子结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com