
Ϊ��̽����������̼�Ƿ���ˮ����ʱ���ܺ������Ʒ�Ӧ����ij�����о�С���ͬѧ���������ͼ��ʵ��װ�ã��ֱ�����˼ס�������ʵ�飺
ʵ��ף�����Ķ�����̼�������Ƶķ�Ӧ���ڸ�����Թܢ���װ��Na2O2����ͨ��CO2֮ǰ���ر�K1��K2�����Թܢ���װ���Լ�X��K1��K2��ͨ��CO2�������Ӻ������ǵ�ľ�������Թܢ��Һ���ϣ��۲쵽ľ������ȼ���Ң��еĵ���ɫû�б仯��
ʵ���ң���ʪ�Ķ�����̼�������Ƶķ�Ӧ�����Թܢ���װ���Լ�Y����������ͬʵ��ף��۲쵽ľ����ȼ���Ң��еĵ���ɫ��Ϊ��ɫ��
�Իش��������⣺
��1����װ��Na2O2��ͨ��CO2ǰ���ر�K1��K2��Ŀ������ֹ��
��2����ʵ����У��Լ�X��Ũ��������ʵ�����У��Լ�Y�ǣ�
��3��������������ʵ�����õ��Ľ����ǣ�
��4��Ϊ��ȷ��ʵ�������ȷ�ԣ��Ʊ�CO2���õķ�Ӧ�����ѡ�ã����ţ���
A������ʯB��С�մ�C���ռ�D������E��ϡ����F��ϡ���ᣮ
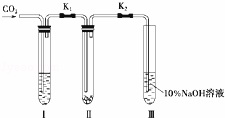
| ����ʵ�鷽������ƣ� | |
| ר�⣺ | ʵ������⣮ |
| ������ | ��1����ֹ��Һ�е�ˮ�������������̼�� ��2��X�Լ������Ǹ��������̼��Y�Լ������Ǹ�������̼�ṩˮ������ ��3��ͨ��ʵ����������� ��4��С�մ���ϡ���ᷴӦ���ɶ�����̼�� |
| ��� | �⣺��1��Ϊ�˷�ֹ��Һ�е�ˮ�������������̼��ʹ��ֹNa2O2�ܳ���������װ��Na2O2��ͨ��CO2ǰ���ر�K1��K2���ʴ�Ϊ����ֹNa2O2�ܳ��� ��2��X�Լ������Ǹ��������̼������XΪŨ���Y�Լ������Ǹ�������̼�ṩˮ����������YΪCO2�ı�����Һ���Լ��ٶ�����̼���ܽ⣬���ṩˮ�������ʴ�Ϊ��Ũ���CO2�ı�����Һ�� ��3������Ķ�����̼ͨ���������ƣ�Ȼ�����ǵ�ľ�������Թܢ��Һ���ϣ��۲쵽ľ������ȼ���Ң��еĵ���ɫû�б仯��˵��û���������ɣ�������Ķ�����̼��������Ʋ���Ӧ�����Թܢ���װ���Լ�Y����������ͬʵ��ף��۲쵽ľ����ȼ���Ң��еĵ���ɫ��Ϊ��ɫ��˵������ˮ�����Ķ�����̼��������Ʒ�Ӧ���������ֻ̼����ˮ����ʱ���ܺ������Ʒ�Ӧ�� �ʴ�Ϊ��������ֻ̼����ˮ����ʱ���ܺ������Ʒ�Ӧ�� ��4��С�մ���ϡ�������ɶ�����̼������ʯ��ϡ���ᷴӦ���ɵ�������������ʣ�����ѡ��С�մ���ϡ�����Ʊ�������̼���ʴ�Ϊ��B��E�� |
| ������ | ���⿼���˹��������������̼��Ӧ��̽��ʵ�飬Ϊ��Ƶ���㣬������ѧ���ķ�����ʵ�������Ŀ��飬��Ŀ�漰�Լ���ѡ��ע�����ʵ���ԭ������Ŀ�Ѷ��еȣ� |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ð�Һ������ӡˢп��ʱ����ϡ���ḯʴп���õ��ġ���Һ��(����������Cl����Fe3��)��ij��ѧ��ȤС�����á��ð�Һ����ȡZn(NO3)2��6H2O�Ĺ������£�

��֪��Zn(NO3)2��6H2O��һ����ɫ���壬ˮ��Һ�����ԣ�Zn(NO3)2����Ӧ���õ��IJ���������ԡ�
(1)���ð�Һ�������ʵ���Ҫ�ɷ���______(�ѧʽ����ͬ)��
(2)�ڲ������б���pH��8��Ŀ����__________________________________________��
(3)���������Ҫ�ɷ���____________��
(4)�������м�����е�Ŀ����________________���˲�����������������
________________________________________________________________________��
(5)�����ܱ���pH��2��Ŀ����____________���˲����������õ���Ҫ������
________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���Ǻϳ����ᡢ��κ͵��ʵĻ���ԭ�ϣ��ش��������⣺
��1������ˮ��Һ�������ԣ���ԭ��Ϊ �������ӷ���ʽ��ʾ����0��1 mol��L-1�İ�ˮ�м���������NH4Cl���壬��Һ��PH ������ߡ����͡�������������������������Һ�е�NH4+��Ũ�� �������С������
 ��2������識��ȷֽ�ɵõ�N2O��H2O��250��ʱ����������ܱ������зֽ�ﵽƽ�⣬�÷ֽⷴӦ�Ļ�ѧ����ʽΪ ��ƽ�ⳣ������ʽΪ ������1mol�������ȫ�ֽ⣬ת�Ƶĵ�����Ϊ mol��
��2������識��ȷֽ�ɵõ�N2O��H2O��250��ʱ����������ܱ������зֽ�ﵽƽ�⣬�÷ֽⷴӦ�Ļ�ѧ����ʽΪ ��ƽ�ⳣ������ʽΪ ������1mol�������ȫ�ֽ⣬ת�Ƶĵ�����Ϊ mol��
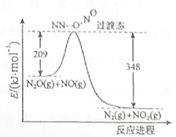
��3����N2O��NO��Ӧ����N2��NO2�������仯��ͼ��ʾ��������1molN2�� ���H= kJ��mol-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
16.8g NaHCO3��7.8g Na2O2���ܱ����������գ���ַ�Ӧ���ܱ����������¶�Ϊ500�森��������ڵ������ǣ���
| A�� | Na2CO3��Na2O2��O2 | B�� | Na2CO3��O2��H2O��g�� | |
| C�� | Na2CO3��CO2��O2��H2O��g�� | D�� | NaHCO3��Na2CO3��O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1L 1.0mol•L��1 NaOH��Һ����0.8mol CO2��������Һ�е�CO32����HCO3����Ũ��֮��Լ�ǣ���
| A�� | 1��3 | B�� | 1��2 | C�� | 2��3 | D�� | 3��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��1��105 Pa��298 K�����£�2 mol����ȼ������ˮ�����ų�484 kJ�����������Ȼ�ѧ����ʽ��ȷ����(����)
A��H2O(g)===H2(g)��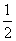 O2(g) ��H����242 kJ��mol��1
O2(g) ��H����242 kJ��mol��1
B��2H2(g)��O2(g)===2H2O(l) ��H����484 kJ��mol��1
C��H2(g)��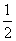 O2(g)===H2O(g) ��H����242 kJ��mol��1
O2(g)===H2O(g) ��H����242 kJ��mol��1
D��2H2(g)��O2(g)===2H2O(g) ��H����484 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ������������У�SO2�ڽӴ����б�������ΪSO3���壬��֪�÷�ӦΪ���ȷ�Ӧ���ֽ�2 mol SO2��1 mol O2����һ�ܱ�������ַ�Ӧ�ų�����98.3 kJ����ʱ���SO2��ת����Ϊ50%���������Ȼ�ѧ����ʽ��ȷ����(����)
A��2SO2(g)��O2(g) 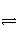
 2SO3(g) ��H����196.6 kJ��mol��1
2SO3(g) ��H����196.6 kJ��mol��1
B��2SO2(g)��O2(g) 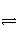
 2SO3(g) ��H����98.3 kJ��mol��1
2SO3(g) ��H����98.3 kJ��mol��1
C��SO2(g)��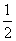 O2(g)
O2(g) 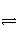
 SO3(g) ��H����98.3 kJ��mol��1
SO3(g) ��H����98.3 kJ��mol��1
D��SO2(g)��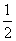 O2(g)
O2(g) 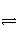
 SO3(g) ��H����196.6 kJ��mol��1
SO3(g) ��H����196.6 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ڻ�ҩ���й��Ŵ����Ĵ���֮һ���䱬ը���Ȼ�ѧ����ʽΪ��
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ��H= x kJ��mol��1
��֪���ȼ���Ȧ�H1= a kJ��mol��1
S(s)+2K(s)==K2S(s) ��H2= b kJ��mol��1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ��H3= c kJ��mol��1
��x�� ��
A��3a+b��c B��c +3a��b C��a+b��c  D��c+a��b
D��c+a��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʽΪC2H4O2�Ľṹ������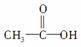 ��
��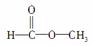 ���֣�Ϊ����ṹ����������������������______________��________________��
���֣�Ϊ����ṹ����������������������______________��________________��
(1)��Ϊ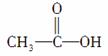 ������������Ӧ����____�������գ��˴Ź���������Ӧ����__________���塣
������������Ӧ����____�������գ��˴Ź���������Ӧ����__________���塣
(2)��Ϊ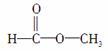 ��������������______�������գ��˴Ź���������Ӧ��______���塣
��������������______�������գ��˴Ź���������Ӧ��______���塣
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com