
| 选项 | 实验 | 结论 |
| A | 相同温度下,向盛有足量稀硫酸的甲、乙两只试管中分别加入等质量的锌粒,并向甲中加入少量胆矾固体 | 产生氢气的速率和体积:甲>乙 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 相同温度下,将等质量的大理石块和大理石粉分别加入到等体积、等浓度的盐酸中 | 反应速率:粉状大理石>块状大理石 |
| D | 向2mL0.1mol•L-1Na2S溶液中滴入几滴0.1mol•L-1ZnSO4溶液,生成白色沉淀;再加入几滴0.1mol•L-1CuSO4溶液,又产生黑色沉淀 | 溶度积:KSP(ZnS)>KSP(CuS) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.由于稀硫酸足量,金属锌的质量相等,则加入胆矾的试管中生成氢气体积偏小;
B.用硫酸酸化,亚铁离子与氢离子、硝酸根离子发生氧化还原反应;
C.固体的接触面积越大,反应速率越快;
D.Na2S溶液过量,均会生成沉淀.
解答 解:A.相同温度下,向盛有足量稀硫酸的甲、乙两只试管中分别加入等质量的锌粒,并向甲中加入少量胆矾固体,甲中形成原电池,则甲中生成氢气速率较大;由于锌的质量相等、硫酸足量,则甲生成氢气体积较少,即产生氢气的速率:甲>乙,产生氢气体积甲<乙,故A错误;
B.用硫酸酸化,亚铁离子与氢离子、硝酸根离子发生氧化还原反应,不能说明亚铁离子是否与过氧化氢反应,则不能比较H2O2、Fe3+的氧化性,故B错误;
C.粉状大理石比块状大理石的接触面积越大,则反应速率为粉状大理石>块状大理石,故C正确;
D.Na2S溶液过量,均发生沉淀的生成,不发生沉淀的转化,则不能比较KSP(ZnS)、KSP(CuS)的大小,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及反应速率的影响因素、氧化还原反应、沉淀的生成等,把握物质的性质、反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子核外有2个电子层 | B. | 最外电子层上有2个电子 | ||
| C. | 比4He多1个中子 | D. | 比4He少 1个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:M>Z>Y | |
| B. | Z元素的最高价氧化物的水化物的化学式为HZO4 | |
| C. | M2Y2中阴离子与阳离子的个数比为1:1 | |
| D. | X的氢化物的沸点低于Y的氢化物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 能与铝反应放出氢气的溶液中:K+、SO42-、NO3-、NH4+ | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
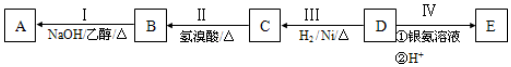
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH值都为4的稀盐酸和NH4Cl溶液中,水的电离程度相同 | |
| B. | 浓度均为0.1mol/L的醋酸和NaOH溶液等体积混合后:lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]=0 | |
| C. | 在含浓度都为0.01mol/L的Cl-、CrO42-的混合溶液中滴加AgNO3溶液,先出现沉淀的是AgCl.[已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12] | |
| D. | 浓度均为0.1mol/L的NH4Cl和CH3COONH4溶液中,c(NH4+)相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 126C是指质子数是6、中子数是12的碳原子 | |
| B. | 醋酸的电离方程式为CH3COOH=CH3COO-+H+ | |
| C. | 钠原子的结构示意图为: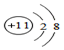 | |
| D. | 4020Ca和4220Ca 互为同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com