
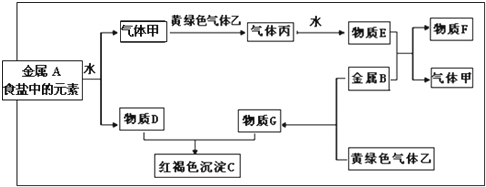
分析 金属A是食盐中的元素为Na,和水反应生成氢氧化钠和氢气,黄绿色气体乙为Cl2,则与Cl2反应的气体甲为H2,丙为HCl,物质E为盐酸,金属A与水反应生成的D为NaOH,盐酸与金属B反应,生成的产物F和气体甲为氢气,金属B与氯气反应生成的G与D氢氧化钠反应生成红褐色沉淀为氢氧化铁,则金属B为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,C为Fe(OH)3,结合物质的性质解答该题.
解答 解:金属A是食盐中的元素为Na,和水反应生成氢氧化钠和氢气,黄绿色气体乙为Cl2,则与Cl2反应的气体甲为H2,丙为HCl,物质E为盐酸,金属A与水反应生成的D为NaOH,盐酸与金属B反应,生成的产物F和气体甲为氢气,金属B与氯气反应生成的G与D氢氧化钠反应生成红褐色沉淀为氢氧化铁,则金属B为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,C为Fe(OH)3.
(1)由以上分析可知,乙为Cl2,F为FeCl2,故答案为:Cl2; FeCl2;
(2)①金属A为钠和水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
②红褐色沉淀C与物质E反应是氢氧化铁和盐酸溶液反应生成氯化铁,反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O,
故答案为:Fe(OH)3+3H+=Fe3++3H2O;
③F与黄绿色气体乙反应是 氯化亚铁和氯气反应生成氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,用氢氧化钠溶液吸收该气体发生反应生成氯化钠、次氯酸钠和水,反应的离子方程式:Cl2+2 OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2 OH-=Cl-+ClO-+H2O;
(3)将FeCl3溶液逐滴加入到沸水中会产生一种红褐色的液体,得到氢氧化铁胶体,该液体中的分散质粒子直径在1-100nm之间,验证的简单方法是:是否有丁达尔现象,
故答案为:1-100nm;是否有丁达尔现象.
(4)金属A为Na,是活泼金属易与水发生反应,需要隔离空气,钠密度大于煤油,应保存在煤油中,故答案为:煤油;
点评 本题考查无机物推断,涉及Na、Al、Fe、Cl等元素单质及其化合物之间的相互转化关系,物质的颜色是推断突破口,难度中等,注意基础知识的掌握.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 能够使品红试液褪色的气体一定是SO2 | |
| B. | 常温下,铁、铝不与浓硫酸反应,因此可以用铁、铝容器贮存运输浓硫酸 | |
| C. | 硝酸铵受热易分解爆炸,实验室常加热氯化铵与氢氧化钙的混合物制备氨气 | |
| D. | 一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5Q | B. | 5Q | C. | 2Q | D. | Q |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X单质不易与水反应 | B. | XO2可被碳或氢气还原为X | ||
| C. | XH4的稳定性比SiH4的高 | D. | XCl4的沸点比SiCl4的高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| B. | 0.1mol甲基中含有的电子数为NA | |
| C. | 2.8 g乙烯和聚乙烯的混合物中所含碳原子数为0.2NA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +172.22 kJ•mol-1 | B. | -172.22 kJ•mol-1 | ||
| C. | +392.92 kJ•mol-1 | D. | -392.92 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com