
| A. | 3a+b-c | B. | c-3a-b | C. | a+b-c | D. | c-a-b |
分析 碳的燃烧热△H1=a kJ•mol-1,其热化学方程式为C(s)+O2(g)=CO2(g)△H1=a kJ•mol-1①
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1②
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1③
将方程式3①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),其反应热进行相应的改变,据此计算反应热.
解答 解:碳的燃烧热△H1=a kJ•mol-1,其热化学方程式为C(s)+O2(g)=CO2(g)△H1=a kJ•mol-1①
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1②
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1③
将方程式3①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),则△H=x kJ•mol-1=(3a+b-c)kJ•mol-1,所以x=3a+b-c,故选A.
点评 本题考查盖斯定律的应用,侧重考查学生分析计算能力,明确目标方程式与已知方程式的关系是解本题关键,注意方程式可以进行加减,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

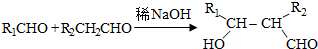
 .
. .
.
 (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

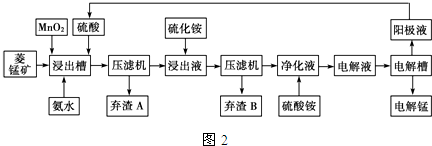
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com