
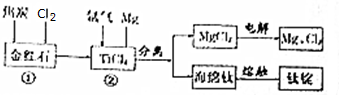
分析 金红石中加入焦炭,通入氯气发生反应生成TiCl4,同时生成CO,在TiCl4中通入氩气、氯气,得到Ti、MgCl2,电解氯化镁可的得到镁,海绵钛经熔融可得到钛锭,
(1)反应①通常在800~900℃的条件下进行,反应的方程式为2C+2Cl2+TiO2$\frac{\underline{\;800-900℃\;}}{\;}$2CO+TiCl4,结合方程式计算;
(2)用Mg还原TiCl4制金属钛取过程中必须在1070K的温度下进行,而在此温度下镁、钛都会与氧气反应;金属钛中混有少量杂质镁,由题给信息知钛的化学活性很小,仅能与氧气等几种物质起反应,而与稀盐酸或稀硫酸等不反应;
(3)流程中用到Mg、Cl2,电解氯化镁可生成Mg、Cl2,则二者可循环使用.
解答 解:金红石中加入焦炭,通入氯气发生反应生成TiCl4,同时生成CO,在TiCl4中通入氩气、氯气,得到Ti、MgCl2,电解氯化镁可的得到镁,海绵钛经熔融可得到钛锭,
(1)反应①通常在800~900℃的条件下进行,反应的方程式为2C+2Cl2+TiO2$\frac{\underline{\;800-900℃\;}}{\;}$2CO+TiCl4,反应中C为还原剂,1mol Cl2完全反应时,有1molC参加反应,故答案为:1;
(2)用Mg还原TiCl4制金属钛取过程中必须在1070K的温度下进行,而在此温度下镁、钛都会与氧气反应,所以反应过程中通入氩气的目的是防止Mg在高温下与空气中O2、CO2等反应,金属钛中混有少量杂质镁,由题给信息知钛的化学活性很小,仅能与氧气等几种物质起反应,而与稀盐酸或稀硫酸等不反应,所以实验操作为①加入过量的稀盐酸②过滤③洗涤、干燥固体,
故答案为:防止Mg在高温下与空气中O2、CO2等反应;①加入过量的稀盐酸②过滤③洗涤、干燥固体;
(3)流程中用到Mg、Cl2,电解氯化镁可生成Mg、Cl2,则二者可循环使用,故答案为:Mg、Cl2.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验的基本原理和物质的性质.


科目:高中化学 来源: 题型:实验题
 现使用酸碱中和滴定法测定市售白醋的浓度.
现使用酸碱中和滴定法测定市售白醋的浓度.次数 数据(mL) | 1 | 2 | 3 |
| V(样品) | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 14.95 | 16.05 | 15.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液化石油气和天然气的主要成分都是甲院 | |
| B. | 苯、乙醇和乙酸都能发生取代反应 | |
| C. | 油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 煤的气化是化学变化,石油分馏是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
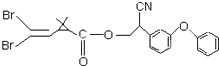 拟除虫菊酯是一类高效、低毒的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图所示,下列对该化合物的叙述中,正确的是( )
拟除虫菊酯是一类高效、低毒的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图所示,下列对该化合物的叙述中,正确的是( )| A. | 属于芳香烃 | B. | 每一个分子内含23个碳原子 | ||
| C. | 属于高分子化合物 | D. | 每一个分子内含7个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molSO2、1molO2 | 1molSO2、0.5molO2 | 2molSO3 |
| k1 | k2 | k3 | |
| 反应的能量变化 | 放出akJ | 放出bkJ | 吸收ckJ |
| 气体密度 | ρ1 | ρ2 | ρ3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | k1=k3<k2 | B. | ρ1=ρ3>ρ2 | C. | α2+α3>1 | D. | 2b+c>197 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com