
以铁为阳极、以铜为阴极,对足量的NaOH溶液进行电解.一段时间后得到2molFe(OH)3沉淀,此时共消耗的水的物质的量为()
A. 2 mol B. 3 mol C. 4 mol D. 5 mol
考点: 电解原理.
专题: 电化学专题.
分析: 活泼金属铁作电解池阳极时,阳极上阳极材料铁失电子发生氧化反应生成亚铁离子进入溶液,亚铁离子和溶液中的氢氧根离子生成氢氧化亚铁沉淀,氢氧化亚铁不稳定,能被氧气氧化成氢氧化铁沉淀,注意消耗的水有两部分:一部分被电解生成氢气,一部分和氢氧化亚铁反应生成氢氧化铁.
解答: 解:根据铁原子守恒知,2molFe(OH)3→2molFe(OH)2,所以生成2molFe(OH)3需要2molFe(OH)2;
活泼金属铁作电解池阳极时,电解氢氧化钠溶液的电解方程式为Fe+2H2O H2+Fe(OH)2↓,
H2+Fe(OH)2↓,
根据电解方程式得,生成2molFe(OH)2需要水的物质的量为4mol;
又氢氧化亚铁不稳定,能被氧气氧化成氢氧化铁沉淀,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
根据方程式得,生成2molFe(OH)3需要水的物质的量为1mol,
所以得到2molFe(OH)3沉淀消耗水的物质的量共为5mol.
故选D.
点评: 本题考查了电解原理,难度不大,注意:活泼金属作电解池阳极时,活泼金属失电子发生氧化反应,而不是溶液中的阴离子失电子发生氧化反应.


科目:高中化学 来源: 题型:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:

(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是 、 ,反射炉内生成炉渣的主要成分是 ;
 (2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、
;
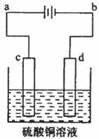
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板是图中电极 (填图中的字母);在电极d上发生的电极反应为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的纯存在形式和位置为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述或操作正确的是( )
E. 浓硫酸具有强氧化性,稀硫酸无氧化性
F. 浓硫酸不慎沾到皮肤上,应立即用布拭去,再用水冲洗,再涂抹NaOH
G.稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,并不断搅拌
H. 浓硫酸与铜的反应中,浓硫酸仅表现强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体
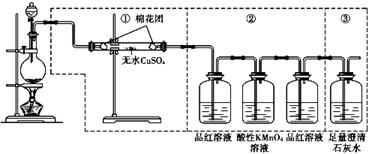 |
(1)如果装置中①.②.③三 部分仪器的连接顺序改为②.①.③,则可以检验出的物
质是 ;不能检出的物质是 。
(2)如果将仪器的连接顺序变
为①.③.②,则可以检出的物质是 ;不能检出的物质是 。
(3)如果将仪器的连接顺序变为②.③.①,则可以检出的物质是 ;不能检出的物质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解精炼铜的叙述中不正确的是()
A. 粗铜板:阳极
B. 电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e﹣═Cu
C. 粗铜中所含Na、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥
D. 电解铜的纯度可达99.95%﹣99.98%
查看答案和解析>>
科目:高中化学 来源: 题型:
你认为减少酸雨产生的途径可采取的措施是 ( )。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加
熟石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
工业接触法制硫酸的简单流程图如下:
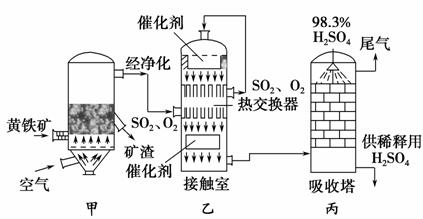
(1)写出装置甲的名称________。要使黄铁矿充分和迅速地燃烧,工业上常采取的措施为__________________________________。
(2)接触室中二氧化硫与氧气的反应采用________(填“常压”或“高压”),原因是____________________________________________________。
(3)刚通入接触室中的SO2和O2在热交换器的管道________(填“里”或“外”)流动,在催化剂表面接触反应的SO2和O2在热交换器的管道________(填“里”或“外”)流动,这样两种流体通过管壁进行热交换。
(4)在吸收塔中为什么用98.3%的浓硫酸而不是用水吸收三氧化硫?______________________________________________________________。
(5)工业接触法制硫酸的过程中,有两个操作过程采用了逆流的原理,它们分别是________________________________________________,
________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

| 溶质的物质的量 浓度/mol·L-1 | 溶液的密度 /g·cm-3 | |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为 (不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为 mol·L-1。
(3)物质的量浓度为c2mol·L-1的氨水与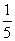 c2mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度
c2mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度 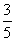 c2mol·L-1(设混合后溶液的体积变化忽略不计)。
c2mol·L-1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了除去KCl中的Ca2+,Mg2+,SO42﹣及泥沙,得到纯净的KCl,可将固体溶于水,然后在下列操作中选取必要的步骤和最佳的操作顺序( )
①过滤 ②加过量KOH溶液 ③加适量盐酸 ④加过量K2CO3溶液 ⑤加过量BaCl2溶液.
|
| A. | ②①⑤①④①③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ①④②⑤③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com