
| A、Li Na K |
| B、Na Mg Al |
| C、Li Be Mg |
| D、Li Na Mg |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
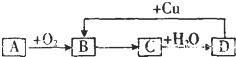 如图,A~D四种物质均含有同一种元素,A是非金属单质,D是最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是( )①C ②N ③Si ④S ⑤Cl.
如图,A~D四种物质均含有同一种元素,A是非金属单质,D是最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是( )①C ②N ③Si ④S ⑤Cl.| A、①② | B、②⑤ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| AB | CD | EF | |
| 离子电荷数 | 1 | 1 | 2 |
| 键长(10-10 m) | 2.31 | 3.18 | 2.10 |
| A、CD>AB>EF |
| B、AB>EF>CD |
| C、AB>CD>EF |
| D、EF>AB>CD |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:Li>Na>K>Rb |
| B、沸点:NH3<PH3<AsH3<SbH3 |
| C、热稳定性:CH4>PH3>H2O>HF |
| D、酸性:HClO>H2SO4>H3PO4>H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1,3丁二烯的结构简式:C4H6 | ||
B、一氯甲烷的电子式: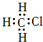 | ||
C、氟原子的结构示意图: | ||
D、中子数为145、质子数为94的钚(Pu)原子:
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com