
| A. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O═H3O++B2- | |
| B. | 电解饱和食盐水:C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e-═4OH- | |
| D. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
分析 A.该反应为电离方程式,且应该使用可逆号;
B.离子方程式两边负电荷不相等,违反了电荷守恒;
C.氢氧燃料电池在碱性介质中的正极氧气得到电子生成氢氧根离子;
D.漏掉了生成氢氧化镁沉淀的反应.
解答 解:A.弱酸酸式盐NaHB在水溶液中水解生成H2B和氢氧根离子,正确的水解方程式为:HB-+H2O?OH-+H2B,故A错误;
B.电解饱和食盐水生成氢氧化钠、氯气和氢气,正确的离子方程式为:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,故B错误;
C.氢氧燃料电池在碱性介质中的正极反应式为:O2+2H2O+4e-═4OH-,故C正确;
D.硫酸镁与氢氧化钡溶液反应生成氢氧化镁沉淀和硫酸钡,正确的离子方程式为:SO42-+Ba2++Mg2++2OH-=Mg(OH)2↓+BaSO4↓,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


科目:高中化学 来源: 题型:解答题
 )可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式:
)可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目
在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)用轨道示意图表示Fe3+的价电子排布
(1)用轨道示意图表示Fe3+的价电子排布 .
.| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质中只含一种元素,所以只含一种元素的物质一定是单质 | |
| B. | 化学变化前后物质的质量总和不变,所以1g H2和1g O2一定能够生成2g H2O | |
| C. | 碱性溶液能使酚酞溶液变红,所以能使酚酞溶液变红的物质一定呈碱性 | |
| D. | 中和反应有盐和水生成,所以有盐和水生的反应一定是中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | W点表示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) | |
| D. | pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

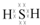 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 | B. | 稀H2SO4 | C. | 稀HCl | D. | 稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向反应后的溶液中继续加入少量铁粉,铁粉可以继续溶解 | |
| B. | 氧化性:Ag+>Fe3+>Cu2+>Zn2+ | |
| C. | 反应后溶液的质量减轻 | |
| D. | 反应后溶液中Cu2+与Fe2+的物质的量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com