
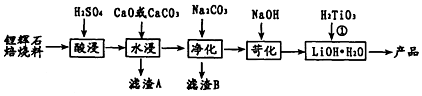
分析 已知锂辉石(主要成分为Li2O•Al2O3•4SiO2)为原材料制备Li2CO3的工艺流程:焙烧Li2O•Al2O3•4SiO2使Al2O3变性,加硫酸,浸取,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Fe3+、Mg2+、Ca2+等杂质,在搅拌下加入石灰石调节pH,使Fe3+转化为氢氧化物沉淀,然后转化为氢氧化铁沉淀,过滤,Na2CO3溶液加入浸出液中,镁离子转化为氢氧化镁沉淀,钙离子转化为碳酸钙沉淀,滤渣B为MgCO3、CaCO3、Mg(OH)2,过滤得硫酸锂溶液,再加氢氧化钠溶液得到LiOH•H2O,与H2TiO3反应得到碳酸锂,据此分析解答.
解答 解:(1)钛酸锂(Li2TiO3)中氧元素-2价,氢元素+1价,化合物化合价代数和为0,则钛元素化合价为+4价;
故答案为:+4;
(2)研碎可是焙烧充分;
故答案为:研磨;
(3)酸浸时Fe2O3与H2SO4反应生成硫酸铁和水,离子方程式为:Fe2O3+6H+=2Fe3+++3H2O;
故答案为:Fe2O3+6H+=2Fe3+++3H2O;
(4)水浸时加入碳酸钙是调整pH,使Fe3+转化为氢氧化物沉淀,Na2CO3溶液加入浸出液中,镁离子转化为氢氧化镁沉淀和MgCO3沉淀,多余的钙离子转化为CaCO3沉淀,故渣B为MgCO3、CaCO3、Mg(OH)2;
故答案为:CaCO3、Mg(OH)2;
(5)H2TiO3与LiOH•H2O反应得到碳酸锂,反应为:H2TiO3+2LiOH•H2O=Li2TiO3+4H2O,则控制H2TiO3与LiOH•H2O物质的量之比为1:2;
故答案为:1:2;
(6)阳离子移向与得电子一极,新型钛酸锂Li4Ti5O12是“寿命最长”的电池负极材料,当Li+迁入时,该电极则得到电子;
故答案为:得到电子.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、原电池原理等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 它是一种共价化合物 | |
| B. | 它只含共价键 | |
| C. | 它不可能与NaOH溶液反应 | |
| D. | 它受热时,可能会分解产生有色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 molSO2与3 molO2反应生成的SO3分子数为2NA | |
| B. | 30 g乙酸和葡萄糖混合物中的氢原子数为2NA | |
| C. | 常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12NA | |
| D. | 标准状况下,2.24 L C2H6含有的共价键数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 反应时间/min | n(X)/mol | n(Y)/mol |
| 0 | 2.00 | 2.40 |
| 10 | 1.00 | |
| 30 | 0.40 |
| A. | 前10 min内反应的平均速率为v(Z)=0.10 mol•L-1•min-1 | |
| B. | 温度为200℃时,上述反应平衡常数为20,则正反应为吸热反应 | |
| C. | 若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积为原来一半,则c(X)<1mol/L | |
| D. | 保持其他条件不变,向容器中再充入1.00 mol X气体和1.20 mol Y气体,到达平衡后,X转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液 | 溶液变成血红色 | Fe(NO3)2已变质 |
| B | 在KI溶液中滴加少量氯水,再加入CCl4,充分震荡. | 液体分层,下层溶液呈紫红色. | 氯的非金属性比碘强 |
| C | 炭粉中加入浓硫酸并加热,导出的气体通入BaCl2溶液中 | 有白色沉淀产生 | 有SO2和CO2产生 |
| D | 向AgNO3溶液中滴加少量NaCl溶液,然后再向其中滴加KI溶液 | 先生成白色沉淀,后生成黄色沉淀 | 溶解度:AgCl>AgI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、蔗糖均可发生银镜反应 | |
| B. | 硫酸铵和乙酸铅均能使蛋白质发生变性 | |
| C. | 乙炔和乙醛均可作为合成聚合物的单体 | |
| D. | 淀粉和油脂都是能够发生水解反应的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
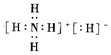 下列有关说法正确的是( )
下列有关说法正确的是( )| A. | 该化合物中氢元素的化合价均为+1价 | |
| B. | 该化合物中只有N原子最外层达到稀有气体的稳定结构 | |
| C. | 该化合物中含有$\stackrel{-1}{H}$与$\stackrel{+1}{H}$,二者互为同位素 | |
| D. | 该化合物中既含有共价键,又含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaOH固体 | B. | 加热升温10℃ | ||
| C. | 加入锌粉 | D. | 加入固体CH3COONa |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com