
某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L﹣1
盐酸、0.55mol•L﹣1NaOH溶液,实验尚缺少的玻璃用品是.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是
(3)他们记录的实验数据如下:
实验用品 溶液温度 中和热
t1 t2 △H
① 50 mL
0.55 mol•L﹣1
NaOH溶液 50 mL
0.5 mol•L﹣1
HCl溶液 20℃ 23.3℃
﹣56.8kJ/mol
② 50 mL
0.55 mol•L﹣1
NaOH溶液 50 mL
0.5 mol•L﹣1
HCl溶液 20℃ 23.5℃
已知:Q=c m(t2﹣t1),反应后溶液的比热容c为4.18kJ•℃﹣1•kg﹣1,各物质的密度均为1g•cm﹣3.
①计算完成上表.
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:.
(4)若用KOH代替NaOH,对测定结果无(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测 定结果(填“有”或“无”)影响.
(5)已知H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ/mol,回答下列问题.
①用含20g NaOH的稀溶液跟足量稀盐酸反应放出kJ的热量.
②用含2mol H2SO4的稀溶液跟足量稀NaOH反应,此反应的中和热△H为.
③如果将反应中的稀盐酸换成稀醋酸,反应放出的热量(填“大于”、“小于”或“等于”)放出的热量.
考点: 中和热的测定.
专题: 实验设计题.
分析: (1)根据各仪器的作用结合中和热实验原理来选取仪器;
(2)金属导热快,热量损失多;
(3)先判断温度差的有效性,然后求出温度差平均值,再根据Q=m•c•△T计算反应放出的热量,然后根据△H=﹣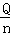 kJ/mol计算出反应热,根据中和热的概念以及热化学方程式的书写方法写出热化学方程式;
kJ/mol计算出反应热,根据中和热的概念以及热化学方程式的书写方法写出热化学方程式;
(4)根据中和热的概念分析,弱电解质电离吸热;
(5)①根据H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1可知,生成1molH2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量即可;
②根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热,和参加反应的量无关;
③根据弱电解质的电离吸热来分析.
解答: 解:(1)测定稀盐酸和稀氢氧化钠的中和热,所需要的玻璃仪器有:大、小两个烧杯、胶头滴管、量筒、温度计以及环形玻璃搅拌器,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,所以还缺少温度计和量筒;
故答案为:量筒;温度计;
(2)不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝搅拌棒是热的良导体,热量损失大,
故答案为:否;金属易导热,热量散失导致误差大;
(3)2次温度差分别为:3.3℃,3.5℃,2组数据都有效,温度差平均值=3.4℃,50mL0.55mol•L﹣1NaOH和50mL.0.5mol•L﹣1HCl质量和为m=100mL×1g/mL=100g,c=4.18J/(g•℃),△T=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.4℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为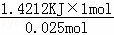 =56.8kJ,即该实验测得的中和热△H=﹣56.8kJ/mol,NaOH溶液与HCl溶液反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=﹣56.8kJ/mol,
=56.8kJ,即该实验测得的中和热△H=﹣56.8kJ/mol,NaOH溶液与HCl溶液反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=﹣56.8kJ/mol,
故答案为:﹣56.8kJ/mol;HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=﹣56.8kJ/mol;
(4)在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热,若用KOH代替NaOH,测定结果无影响,醋酸为弱酸,电离过程为吸热过程,所以用醋酸代替HCl做实验,反应放出的热量小于56.8kJ,测定结果偏小,对测定结果有影响,
故答案为:无;有;
(5)①H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1可知,生成1molH2O放出热量为57.3kJ,
20gNaOH即0.5mol氢氧化钠配成稀溶液后,氢氧根离子的浓度是0.5mol,和足量的酸之间反应会生成0.5mol水,所以放出热量为0.5×57.3kJ=28.65kJ,
故答案为:28.65;
②用2molH2SO4配稀溶液跟足量稀NaOH反应,会生成水4mol,所以放出热量为4×57.3kJ=229.2kJ,但中和热指稀的强酸和强碱反应生成1mol水所放出的热量,所以中和热和参加反应的量无关,此反应的中和热△H为为=﹣57.3kJ/mol,
故答案为:﹣57.3kJ/mol;
③由于醋酸是弱酸,电离是吸热的,所以导致放出的热量数值偏低,
故答案为:小于;
点评: 本题考查中和热的测定,题目难度不大,注意热量计算公式的应用中c=4.18J/(g•℃),要注意热量单位的换算,注意中和热的定义.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
下列说法正确的是
A.实验中要配制500 mL 0.2 mol·L-1 KCl溶液,需用托盘天平称量7.45g KCl固体
B.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
C.排除碱式滴定管尖嘴端气泡时,可以向上弯曲橡皮管,然后挤压玻璃球,排出气泡
D.往含有FeBr2和FeI2的混合溶液中通入足量的氯气,然后把溶液蒸干、灼烧,得到FeCl3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得溶液pH=10,则强酸与强碱的体积比是( )
|
| A. | 1:9 | B. | 9:1 | C. | 1:11 | D. | 11:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关能源与能量的说法正确的是()
A. 煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源
B. 蒸汽属于一次能源
C. 凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应
D. 反应物和生成物的总能量决定反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的()
A. 碳酸钠(固体) B. 石灰水 C. 硫酸钾溶液 D. 硫酸铵(固体)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质性质的叙述中,正确的是( )
A.Cl2能与金属活动顺序表中大多数金属反应
B.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
C.硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性
D.硅是应用广泛的半导体材料,常温下化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是( )
A.硅酸钠溶液中通入CO2气体:SiO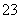 +H2O+CO2===H2SiO3↓+CO
+H2O+CO2===H2SiO3↓+CO
B.硫酸铝与氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH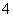
C.氯气与氢氧化钾溶液反应:Cl2+OH-===Cl-+ClO-+2H2O
D.小苏打溶液与稀盐酸反应:HCO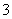 +H+===H2O+CO2↑
+H+===H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是()
X Y
Z W
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 气态氢化物的稳定性:Z>W
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com