
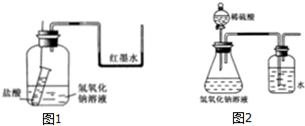
分析 (1)若反应为放热反应,则U形管内液面左低右高;
(2)CH3COOH的电离吸热,则测定最高温度偏低;
(3)若洗气瓶中导管口有气泡冒出,则说明该反应放出热量,为放热反应,则
①实验时,打开分液漏斗活塞,发现导管流出液体不畅,可能上部塞子没有打开;
②从原理上讲,该实验设计不合理,因溶液的加入导致瓶内气体压强增大,气体被压入洗气瓶中.
解答 解:(1)开始时使右端U形管两端品红溶液相平.实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内氢氧化钠溶液混合,此时观察到的现象是U形管内液面左边下降、右边升高,原因是盐酸和氢氧化钠发生中和反应放出热量,使瓶内气体温度升高,压强增大,
故答案为:U形管内液面左边下降、右边升高;盐酸和氢氧化钠发生中和反应放出热量,使瓶内气体温度升高,压强增大;
(2)酸碱中和为放热反应,而CH3COOH的电离吸热,则用CH3COOH代替稀盐酸或稀硫酸,反应后所测温度温度偏低,故答案为:偏低;
(3)①实验时,打开分液漏斗活塞,发现导管流出液体不畅,原因可能是没打开分液漏斗上部塞子,
故答案为:没打开分液漏斗上部塞子;
②从原理上讲,该实验设计不合理,理由是稀硫酸具有一定的体积,冒出气泡的原因可能是加入稀硫酸的体积引起的,故答案为:不合理;稀硫酸具有一定的体积,冒出气泡的原因可能是加入稀硫酸的体积引起的.
点评 本题考查实验方案的设计,为高频考点,把握中和反应中能量变化、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意实验设计与压强的关系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为p轨道是“8”字形的,所以p的电子走“8”字形 | |
| B. | K能级有3s,3p,3d,3f四个轨道 | |
| C. | 碳原子的2p轨道上有两个自旋相反的电子 | |
| D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com