
| |||||||||||||||||||||||||||||||||

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 HS-+OH-
HS-+OH- HS-+OH-
HS-+OH-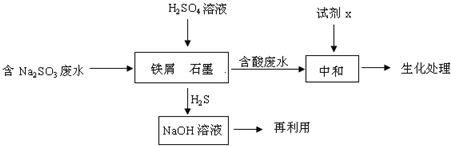
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| 3 |
| 2 |

| c4(H2O) |
| c4(H2) |
| c4(H2O) |
| c4(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(16��)��1����֪:
Fe��s��+1/2O2��g��=FeO��s�� ![]()
2Al��s��+3/2O2��g��= Al2O3��s�� ![]()
Al��FeO�������ȷ�Ӧ���Ȼ�ѧ����ʽ��_____________________________________��
��2����Ӧ�����������Ϊ��̬��ij���淴Ӧ�ڲ�ͬ�����µķ�Ӧ���̷ֱ�ΪA��B������ͼ��ʾ��
�پ�ͼ�жϸ÷�Ӧ��_____(������š�)�ȷ�Ӧ������Ӧ�ﵽƽ��������������䣬�����¶ȣ���Ӧ���ת����__ _ _ (���������С�����䡱)
������B���̱����˷�Ӧ���õ�����Ϊ______ (ѡ�����������ĸ)
A�������¶� B������Ӧ���Ũ��
C�������¶� D��ʹ���˴���
��3��1000��ʱ���������������������з�Ӧ��Na2SO4(s)+ 4H2(g) Na2S(s)+ 4H2O(g) ��
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ____________________����֪K1000����K1200������÷�Ӧ��________��Ӧ������ȡ����ȡ�����
�����й����ӷ���ʽ˵��������Ӧ���ù�������ˮ��Һ�������____________
��4�������£����ȡ0.1mol��L��1HA��Һ��0.1mol��L��1NaOH��Һ�������ϣ���Ϻ���Һ����ı仯���Բ��ƣ�����û��Һ��pH��8����ش��������⣺
�ٻ����Һ��ˮ�������c(H��)��0.1mol��L��1NaOH��Һ��ˮ�������c(H��)�Ƚ�
���������������
����֪NH4A��ҺΪ���ԣ���֪��HA��Һ�ӵ�Na2CO3��Һ��������ų������ƶ�(NH4)2CO3��Һ��pH 7�����������������ͬ�¶��£������ʵ���Ũ�ȵ���������Һ��pH�ɴ�С������˳��Ϊ ��������ţ�
a.��NH4HCO3 b��NH4A c��(NH4)2CO3 d��NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��14�֣���ҵ�����к����ˮ���ŷŻ���Ⱦ��������Ҫ�Ժ����ˮ���д��������á�
��1��ij�Ƹﳧ�����ˮ����Ҫ��������Na2S��
�� ��ø÷�ˮ��ҺpH=12�������ӷ���ʽ������Һ�ʼ��Ե�ԭ�� ��
�� �����ˮ�Ĵ��������п��Բ��ô�����Na2Sת��ΪNa2SO4����Ӧ�л�ԭ���������������ʵ���֮��Ϊ ����֪1000��ʱ���������������������з�Ӧ��Na2SO4(s) + 4H2(g)Na2S(s)+ 4H2O(g) ����֪�÷�Ӧ��ƽ�ⳣ��K1000����K1400������÷�Ӧ�ġ�H______0���>����=����<������
��2������ȼ���м����ˮ����Ҫ������ΪNa2SO3�����շ�ˮ�е�����Լ�����Դ���˷ѣ��ɲ������·�����
�� �кͺ����ˮ��ҵ���õ��Լ�x�� ��
�� д��H2S����������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ ��
�� ��м��ʯī���γ���ԭ��أ�SO32�������������·ŵ�����H2S��������Ӷ��ﵽ�ӷ�ˮ�г�ȥNa2SO3��Ŀ�ģ�д��SO32�������������·ŵ�����H2S�ĵ缫��Ӧʽ�� ��
�� ��֪��2H2S(g)+O2(g) =2 S(s) +2 H2O(l) ��H= ��632.8 kJ/mol
SO2 (g) = S(s) + O2(g) ��H= +269.8kJ/mol
H2S��O2��Ӧ����SO2��H2O���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���������������ѧ�߶���ѧ����ĩ�������ƻ�ѧ�Ծ����������� ���ͣ������
(1)��֪��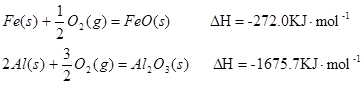
Al��FeO�������ȷ�Ӧ���Ȼ�ѧ����ʽ�� ����3�֣�
(2)ij���淴Ӧ�ڲ�ͬ�����µķ�Ӧ���̷ֱ�ΪA��B����ͼ��ʾ��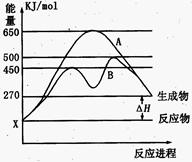
�پ�ͼ�жϸ÷�Ӧ�� (������š�)�ȷ�Ӧ������Ӧ�ﵽƽ��������������䣬�����¶ȣ���Ӧ���ת���� (���������С�����䡱)��
������B���̱����˷�Ӧ���õ�����Ϊ (ѡ�����)��
A�������¶� B������Ӧ���Ũ��
C�������¶� D��ʹ�ô���
(3)1000��ʱ���������������������з�Ӧ��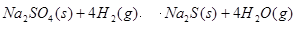 �÷�Ӧ��ƽ�ⳣ������ʽΪ ��
�÷�Ӧ��ƽ�ⳣ������ʽΪ ��
(4)�����£����ȡ0.1mol��L-1HA��Һ��0.1mol��L-1NaOH��Һ��������(��Ϻ���Һ����ı仯���Բ���)����û��Һ��pH=8��
�ٻ��Һ����ˮ�������OH-Ũ����0.1mol��L-1NaOH��Һ����ˮ�������OH-Ũ��֮��Ϊ ��
����֪NH4A��ҺΪ���ԣ���֪��HA��Һ�ӵ�Na2CO3��Һ��������ų������ƶ�(NH4)2CO3��Һ��pH 7(�<������>����=��)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com