
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g),ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:
nY(g),ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:

下列说法正确的是
A.m>n
B.温度不变,压强增大,Y的质量分数减少
C.Q<0
D.体积不变,温度升高,平衡向逆反应方向移动
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:2016届江西省九江市七校高三第一次联考化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系(如图):下列有关物质的推断不正确的是
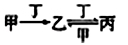
A.若甲为AlCl3溶液,则丁可能是NaOH溶液
B.若甲为氮气,则丁可能是O2
C.若甲为Fe,则丁可能是稀硝酸
D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:实验题
(15分)硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有CO2,应选择的试剂有 。
A.NaOH溶液 B.酸性KMnO4溶液 C.澄清石灰水 D.盐酸
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。
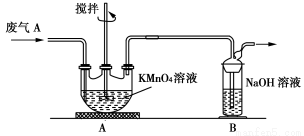
①为了保证实验成功,装置A应具有的现象是 ,搅拌的目的是 。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是 。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4•7H2O)。实验模拟制备皓矾工业流程如下:

①“氧化”中加入硫酸铁发生反应的离子方程式是 。
②加入Zn粉的目的是 。
③固体A主要成分是 。
④操作b得到纯净皓矾晶体,必要的操作是 、 、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁育才学校高一上第一次阶段测化学试卷(解析版) 题型:选择题
常温下,欲配制密度为1.1 g·cm-3、浓度为6 mol·L-1的稀盐酸,在体积为100 mL、密度为1.19 g·cm-3、浓度为12 mol·L-1的浓盐酸中需加蒸馏水
A.200 mL B.100 mL C.101 mL D.120 mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上期中测试化学试卷(解析版) 题型:选择题
FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述中不正确的是
A.Fe(OH)3胶体区别于其它分散系的本质特征是分散质粒子的直径在10-9~10-7米之间
B.分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应
C.三种分散系的颜色都相同,且均能与盐酸反应,具有吸附性
D.三种分散系中分散质均属于电解质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高二上10月月考化学试卷(解析版) 题型:选择题
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
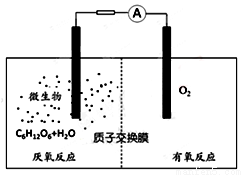
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高一上10月月考化学试卷(解析版) 题型:选择题
金属钠与下列物质的溶液反应,既有沉淀生成又有气体放出的是
A.Mg(NO3)2 B.HNO3 C.Na2SO4 D.NH4Cl
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第三次月考化学试卷(解析版) 题型:选择题
某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物②煤和石油都是可再生能源③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质④不锈钢和目前流通的硬币都是合金⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物⑥豆浆和雾都是胶体。上述说法正确的是
A.①②④⑤ B.①③④⑥ C.①⑤⑥ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期第一次模拟化学试卷(解析版) 题型:填空题
(14分)工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:(已知:NaCl熔点为801℃;AlCl3在181℃升华)

(1)钢材镀铝后,抗腐蚀性能会大大增强,其原因是 。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有 ,固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 。
(3)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 。
(4)向滤液中通入过量CO2所发生反应的离子方程式为 。
(5)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com