
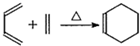
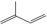
 ,写出属于A的同一类别物质且存在顺反异构的有机物结构简式CH3CH=CHCH=CH2.
,写出属于A的同一类别物质且存在顺反异构的有机物结构简式CH3CH=CHCH=CH2. .
. .
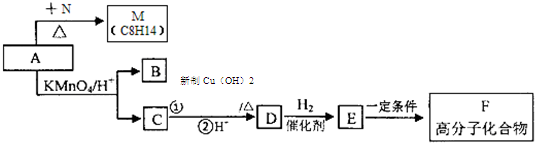
.分析 X的产量可以用来衡量一个国家石油化工发展水平,则X为CH2=CH2,N是X最简单的同系物,则N为CH2=CH2CH3,A与N发生信息①中的加成反应生成M(C8H14),则A的分子式为C5H8,由(2)M与足量的氢气加成后的产物P的一氯代物只有3种,P为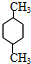 ,M为
,M为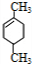 ,A为
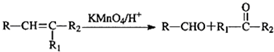
,A为 .A发生信息②中的氧化反应生成B与C,而C能与新制氢氧化铜反应生成D,D能与氢气反应生成E,可知C为
.A发生信息②中的氧化反应生成B与C,而C能与新制氢氧化铜反应生成D,D能与氢气反应生成E,可知C为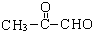 ,B为HCHO,故D为
,B为HCHO,故D为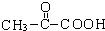 ,E为
,E为 ,E发生发生缩聚反应生成F为
,E发生发生缩聚反应生成F为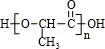 .
.
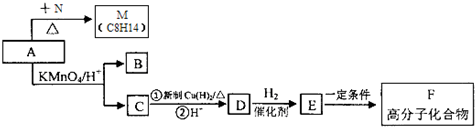
解答 解:X的产量可以用来衡量一个国家石油化工发展水平,则X为CH2=CH2,N是X最简单的同系物,则N为CH2=CH2CH3,A与N发生信息①中的加成反应生成M(C8H14),则A的分子式为C5H8,由(2)M与足量的氢气加成后的产物P的一氯代物只有3种,P为 ,M为
,M为 ,A为
,A为 .A发生信息②中的氧化反应生成B与C,而C能与新制氢氧化铜反应生成D,D能与氢气反应生成E,可知C为
.A发生信息②中的氧化反应生成B与C,而C能与新制氢氧化铜反应生成D,D能与氢气反应生成E,可知C为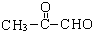 ,B为HCHO,故D为
,B为HCHO,故D为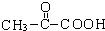 ,E为
,E为 ,E发生发生缩聚反应生成F为
,E发生发生缩聚反应生成F为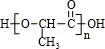 .
.
(1)由上述分析可知,A的结构简式为 ,属于A的同一类别物质且存在顺反异构的有机物结构简式为:CH3CH=CHCH=CH2,
,属于A的同一类别物质且存在顺反异构的有机物结构简式为:CH3CH=CHCH=CH2,
故答案为: ;CH3CH=CHCH=CH2;
;CH3CH=CHCH=CH2;
(2)P为 ,P的名称为1,4-二甲基环己烷,
,P的名称为1,4-二甲基环己烷,
故答案为:1,4-二甲基环己烷;
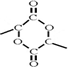
(3)E→F是 发生发生缩聚反应生成
发生发生缩聚反应生成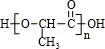 ,反应方程式为:
,反应方程式为: ,
,
故答案为:缩聚反应; ;
;
(4)E( )在浓硫酸存在下能生成多种化合物,其含有六元环为:
)在浓硫酸存在下能生成多种化合物,其含有六元环为: ,
,
故答案为: ;
;
(5)现有另一种有机物G,已知G与E( )无论按何种比例混合,只要总质量一定,完全燃烧时生成的CO2、H2O以及消耗的O2均为定值,为同分异构体或最简式相同,且M(G)<M (E),则G的分子式为C2H4O2或者CH2O,G的核磁共振氢谱有两个峰,且峰面积比为1:3,符合条件的结构简式为:CH3COOH、HCOOCH3,
)无论按何种比例混合,只要总质量一定,完全燃烧时生成的CO2、H2O以及消耗的O2均为定值,为同分异构体或最简式相同,且M(G)<M (E),则G的分子式为C2H4O2或者CH2O,G的核磁共振氢谱有两个峰,且峰面积比为1:3,符合条件的结构简式为:CH3COOH、HCOOCH3,
故答案为:CH3COOH、HCOOCH3;
(6)化合物E( )的同分异构体满足下列要求:①分子中含有-COO-基团,含有酯基或羧基,②能与金属钠反应,至少含有羧基、羟基中的一种,可能的结构简式有:HOCH2CH2COOH,CH3OCH2COOH,CH3CH2OCOOH,HOCH2CH2OOCH,CH3CH(OH)OOCH,HOCH2OOCCH3,CH3OOCCH2OH,共7种,
)的同分异构体满足下列要求:①分子中含有-COO-基团,含有酯基或羧基,②能与金属钠反应,至少含有羧基、羟基中的一种,可能的结构简式有:HOCH2CH2COOH,CH3OCH2COOH,CH3CH2OCOOH,HOCH2CH2OOCH,CH3CH(OH)OOCH,HOCH2OOCCH3,CH3OOCCH2OH,共7种,
故答案为:7.
点评 本题考查有机物的推断,注意结合问题中P的一氯代物有3种确定物质的结构简式,侧重考查学生分析推理能力、自学能力、信息获取与迁移运用能力,难度中等.


科目:高中化学 来源: 题型:解答题
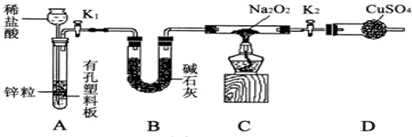 钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂.Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应.为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下.
钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂.Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应.为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入KSCN溶液,若溶液变成血红色,则一定有Fe3+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了防止中秋月饼的富脂食物因被氧化而变质,常在包装袋里放还原铁粉 | |
| B. | 天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点 | |
| C. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 | |
| D. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用如图装置收集气体并验证其某些化学性质,正确的是( )
利用如图装置收集气体并验证其某些化学性质,正确的是( )| 选项 | 气体 | 试剂② | 现象 | 结论 |
| A | NH3 | 酚酞试液 | 溶液变红色 | NH3的水溶液显碱性 |
| B | Cl2 | 紫色石蕊试液 | 溶液立即褪色 | Cl2有氧化性 |
| C | SO2 | 溴水 | 溶液褪色 | SO2有漂白性 |
| D | X(能形成酸雨) | KI淀粉溶液 | 溶液变蓝 | X是NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
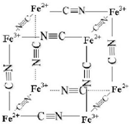 铁及其化合物在生产生活及科学研究方面应用非常广泛.
铁及其化合物在生产生活及科学研究方面应用非常广泛. ,其空间构型为直线型.
,其空间构型为直线型.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| B. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| C. | PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,新修订的《环境空气质量标准》增设了PM2.5 平均浓度限值,是因为PM2.5在空气中形成了分散系一定是气溶胶,且富含有害物质,对空气质量影响较大 | |
| D. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 1 mol•L-1的NaHCO3溶液中,含有HCO3-与CO32-的数目之和为0.1 NA | |
| B. | 用惰性电极电解MgCl2溶液,导线中流过2NA个e-时,生成24 g Mg | |
| C. | 标准状况下,11.2 L C2H6中含有极性键的数目为3.5NA | |
| D. | 常温常压下,20 g H218O中含有的中子数目为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com