
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)在酸浸过程中会适当增大酸的浓度并不断快速搅拌,目的是______________。
(2)写出“沉镍”时发生反应的离子方程式:______________________________,当Ca2+沉淀完全时,溶液中 c(F-)> ________mol·L-1(写出计算式即可)。
(3)试剂a是一种绿色氧化剂,写出“氧化”时反应的化学反应方程式:_______________________________。
(4)操作a的内容包括过滤,洗涤,干燥。请用简洁语言描述洗涤的方法是__________________________。
(5)“调pH”时pH的调控范围为______≤PH<6.8。
【答案】提高“酸浸”速率 Ni2++C2O42-+2H2O=![]()
![]() 2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O 过滤结束后,沿玻璃棒往漏斗中注水至淹没沉淀待水自然流下,重复操作2-3次 5.0
2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O 过滤结束后,沿玻璃棒往漏斗中注水至淹没沉淀待水自然流下,重复操作2-3次 5.0
【解析】
废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等),用硫酸溶解,SiO2不与硫酸反应,过滤得到滤液中含有NiSO4、FeSO4、Al2(SO4)3、CaSO4及过量的硫酸;试剂a是一种绿色氧化剂,a是H2O2, H2O2将Fe2+氧化为Fe3+,加入Ni(OH)2调节pH,使pH大于5.0小于6.8,Fe3+转化为Fe(OH)3沉淀、Al3+转化为Al)OH)3沉淀,过滤除去,滤液中含有NiSO4、CaSO4,向滤液中加入NH4F,除去Ca2+,过滤,再向滤液中加入(NH4)2C2O4,得到草酸镍沉淀,再过滤、洗涤、干燥得草酸镍晶体,据此答题。
(1)根据影响化学反应速率的因素可知,适当增大酸的浓度并不断快速搅拌,可提高浸出率;
(2)向NiSO4溶液中加入(NH4)2C2O4,得到草酸镍沉淀,“沉镍”时反应的离子方程式为:Ni2++C2O42-+2H2O=![]() ,当Ca2+沉淀完全时,Ca2+的浓度小于1.0×10-5 mol·L-1,根据氟化钙的溶度积常数,溶液中 c(F-)>
,当Ca2+沉淀完全时,Ca2+的浓度小于1.0×10-5 mol·L-1,根据氟化钙的溶度积常数,溶液中 c(F-)>![]() ;
;
(3)试剂a是一种绿色氧化剂,所以加入的a是H2O2,亚铁离子被氧化成铁离子,所以“氧化”时反应的化学反应方程式为2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O;
(4)操作a的内容包括过滤,洗涤,干燥。洗涤沉淀的方法是过滤结束后,沿玻璃棒往漏斗中注水至淹没沉淀待水自然流下,重复操作2-3次;
(5)根据表中的数据可知,pH为5.0时,Fe3+、Al3+沉淀完全,pH为6.8时Ni2+开始沉淀,所以pH的调控范围为5.0≤PH<6.8。


科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、![]() 及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。下列操作顺序中最合适的是
及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。下列操作顺序中最合适的是
A.①④②⑤③B.④①②⑤③C.②⑤④①③D.⑤②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表短周期中六种元素的原子序数与主要化合价的关系如图:
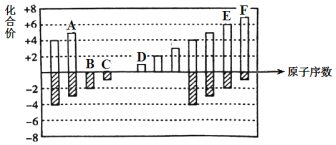
(1)E在元素周期表中的位置是_________。
(2)C、D、F原子半径由大到小的顺序是____________(填元素符号)。
(3)A、B、C的单质与氢气反应剧烈程度由强到弱的顺序____________.(用单质的化学 式表示)。
(4)应用元素周期律和元素周期表的知识,写出D和E形成的化合物的化学式_________、________(写2种)。
(5)判断F的单质和E的最简单氢化物之间能否发生反应,若能则写出反应的化学方程式,若不能则说明理由________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列八种物质:①铝 ②![]() 溶液 ③蔗糖固体 ④稀硫酸 ⑤熔融的
溶液 ③蔗糖固体 ④稀硫酸 ⑤熔融的![]() ⑥
⑥![]() 饱和溶液 ⑦
饱和溶液 ⑦![]() ⑧新制备的氢氧化铁胶体分散系
⑧新制备的氢氧化铁胶体分散系
(1)上述物质属于非电解质的有_________(填序号)。
(2)上述物质能导电且属于电解质的有_________(填序号)。
(3)若将⑥滴入下列物质中,能形成⑧的是_________(填字母代号)。
A.![]() 浓溶液 B.
浓溶液 B.![]() 浓溶液 C.冷水 D.沸水
浓溶液 C.冷水 D.沸水
(4)可利用哪种效应鉴别⑥和⑧:______________________。
(5)⑦和足量②反应的离子方程式为______________________。
(6)①与⑤的水溶液反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g)=C(g)+gD(g);△H<0,下列结论中错误的是( )
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若m+n=p+q,则往含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2a
C.若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的![]() 要小
要小
D.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO的变化如图所示,p2和195℃时n(H2)随时间的变化结果如下表所示。下列说法正确的是( )
CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO的变化如图所示,p2和195℃时n(H2)随时间的变化结果如下表所示。下列说法正确的是( )
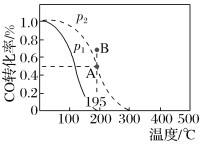
p2和195℃时n(H2)
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A.p2和195℃时,0~3min,反应速率v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
B.p1<p2,ΔH>0
C.在p2和195℃时,该反应的平衡常数为25
D.195℃、p2时,在B点:v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的铜片与![]() 浓硫酸加热充分反应,收集到标准状况下的
浓硫酸加热充分反应,收集到标准状况下的![]() 气体VL,下列对此反应的有关说法中错误的是
气体VL,下列对此反应的有关说法中错误的是 ![]()
A. 该反应体现了浓硫酸的酸性和强氧化性
B. 反应结束后两种反应物均有剩余
C. 被还原的硫酸为![]()
D. 参加反应的Cu为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的名称、图形、用途与使用操作的叙述均正确的是( )
选项 | A | B | C | D |
名称 | 250 mL容量瓶 | 分液漏斗 | 酸式滴定管 | 冷凝管 |
图形 |
|
|
|
|
用途与使用操作 | 配制1.0 mol·L-1NaCl溶液,定容时俯视刻度,则配得的溶液浓度小于1.0 mol·L-1 | 用甘油萃取碘水中的碘,分液时,碘层需从上口放出 | 可用于量取10.00mL 新制氯水溶液 | 蒸馏实验中将蒸气冷凝为液体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-甲基-1,3-丁二烯是一种重要的化工原料。可以发生以下反应。
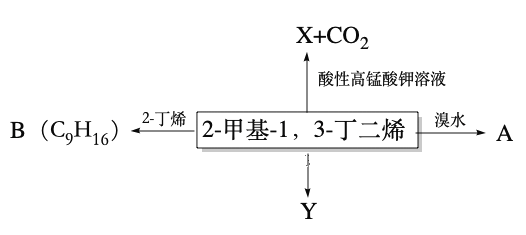
已知:
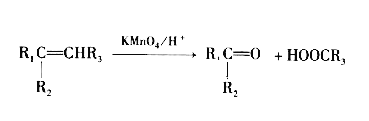
请回答下列问题:
(1)2-甲基-1,3-丁二烯与溴水发生加成反应。
① 完全加成所得有机产物的结构简式______________________________;
② 发生1,2-加成所得有机产物的化学方程式为 __________________________________;
③ 发生1,4-加成反应的名称为__________________。
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与2-丁烯反应的化学方程式___________________________ 。
(3)Y(![]() )是天然橡胶的主要成分,能发生的反应有___________填标号)。
)是天然橡胶的主要成分,能发生的反应有___________填标号)。
A.加成反应 B.氧化反应 C.消去反应 D.酯化反应
(4)X的分子式为C3H4O3,其结构简式为_________________; X与丙醇发生酯化反应的化学方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com